Spis treści
- Rola miedzi w chorobach tarczycy
- Rola miedzi w chorobach układu sercowo-naczyniowego
- Rola miedzi w chorobach układu nerwowego
- Wpływ miedzi na płodność u mężczyzn
- Diagnostyka zawartości miedzi w organizmie człowieka – testy z krwi i z moczu, kiedy zrobić badanie?
Miedź to bardzo ważny mikroelement w naszym organizmie. Jego zawartość w organizmie człowieka nie jest wysoka, jednak poprzez fakt, iż jest ona kofaktorem wielu reakcji enzymatycznych (dowiedz się więcej TUTAJ), jej rolę można zaobserwować w wielu miejscach naszego organizmu. Ostatnio coraz więcej mówi się o roli miedzi w chorobach tarczycy, niektórzy pacjenci chcieliby ją suplementować. Takie podejście nie jest uzasadnione, nadmierna suplementacja miedzi jest niekorzystna dla organizmu, zdecydowanie lepiej dostarczać ją z dietą i w ten sposób zapewnić optymalny poziom miedzi w organizmie.
Rola miedzi w chorobach tarczycy
Znaczenie miedzi w chorobach tarczycy ciągle jest kwestią badań. Na dziś wiemy, iż w badaniach na zwierzętach wykazano, iż podwyższony poziom miedzi związany jest z występowaniem niedoczynności tarczycy i podwyższonym poziomem TSH, natomiast stosunkowo niski poziom miedzi jest związany z nadczynnością tarczycy. Są również doniesienia wskazujące, iż poziom miedzi skorelowany jest z poziomem hormonów tarczycy. Redukcja stężenia miedzi może zwiększać stres oksydacyjny, powodując mniejszą produkcję hormonów tarczycy i spadek ich stężenia we krwi.
Badania eksperymentalne na myszach wskazują również, iż poziom hormonów tarczycy może wpływać na stężenie miedzi we krwi, poprzez zwiększenie jej uwalniania z magazynów w wątrobie. Badania przeprowadzone wśród pacjentów z nadczynnością tarczycy leczonych radioaktywnym jodem skutkowało zmniejszeniem poziomu hormonów tarczycy oraz poziomu miedzi.
Osobnym zagadnieniem jest korelacja pomiędzy stężeniem miedzi oraz chorobami autoimmunologicznymi tarczycy. Istnieją doniesienia, iż wysokie stężenie miedzi w surowicy jest skorelowane dodatnio z podwyższonym poziomem przeciwciał tarczycowych. Istnieją jednak doniesienia przeczące tej hipotezie, gdzie nie wykazano takiego powiązania.
Trwają również badania nad powiązaniem poziomu miedzi z nowotworami tarczycy. Uważa się, iż miedź rozpoczyna angiogenezę, czyli tworzenie naczyń krwionośnych w tkance nowotworowej, co sprzyja rozrostowi komórek złośliwych.
Podsumowując, doniesienia na temat wpływu miedzi na pracę tarczycy i produkcję przez nią hormonów wymagają dalszych badań. Wiemy, że miedź może mieć istotne znaczenie dla prawidłowej funkcji tego narządu. Biorąc jednak pod uwagę fakt, iż mamy do czynienia z mikropierwiastkiem, gdzie niewielkie wahania stężenia mają znaczenie, należy podkreślić, że dystrybucja i ilość biodostępnej miedzi musi być kontrolowana, co na dziś najłatwiej jest uzyskać poprzez spożycie miedzi z dietą.

Rola miedzi w chorobach układu sercowo-naczyniowego
Choroby układu sercowo-naczyniowego są jednymi z najczęstszych schorzeń występujących w krajach Europy Zachodniej i USA, są główną przyczyną śmiertelności. Miedź to pierwiastek śladowy, którego rola w patogenezie chorób serca nie była do tej pory rozpatrywana. Temat jednak ostatnio zyskuje na znaczeniu, rola miedzi jako kofaktora bardzo wielu reakcji enzymatycznych oraz czynnika biorącego udział w budowaniu kolagenu i elastyny skłania badaczy do przyjrzenia się temu zagadnieniu. Pojawiają się dowody wskazujące na to, iż brak równowagi w homeostazie miedzi przyczynia się do chorób serca. Zaburzenia regulacji białek transportujących miedź lub niedobory tego pierwiastka skutkują hipertofią mięśnia sercowego, niewydolnością serca, chorobą niedokrwienną serca czy kardiomiopatią cukrzycową.
Mechanizm wpływu miedzi na patogenezę chorób serca może być różny. Jednym z badanych zagadnień jest powiązanie stężenia ceruloplazminy – głównego białka transportującego miedź – z działaniem na czynność serca. Niedobór miedzi, zmniejszający aktywność ceruloplazminy i wpływający na homeostazę żelaza został powiązany z wystąpieniem cukrzycy, otyłości, dyslipidemii i miażdżycy. Coraz więcej badań klinicznych pokazuje, iż krążąca ceruloplazmina koreluje z ryzykiem chorób sercowo-naczyniowych oraz może być czynnikiem prognostycznym ryzyka tych chorób. Konieczne są jednak dalsze badania, aby zrozumieć, czy podwyższona krążąca ceruloplazmina odgrywa rolę w patogenezie chorób serca.
Innym mechanizmem, który jest rozpatrywany w powiązaniu poziomu miedzi i prawidłowej funkcji serca, jest jej udział w budowie kolageniu i elastyny. Nieprawidłowości w usieciowaniu tych białek skutkują mniejszą wytrzymałością tkanki łącznej, a co za tym idzie problemami w pracy serca, zaburzeniami skurczu i jego przerostem.
Choroby serca powodują ogromne obciążenia zdrowotne i ekonomiczne na całym świecie, i chociaż niedobór miedzi wpływa na wiele tkanek, w tym na wątrobę, jelita, układ naczyniowy, mózg i tkankę tłuszczową, serce wydaje się być jedną z najbardziej wrażliwych na niedobór miedzi tkanek.
Rola miedzi w chorobach układu nerwowego
Miedź odgrywa ważną rolę w funkcjonowaniu układu nerwowego poprzez swoje uczestnictwo w reakcjach enzymatycznych. Jej obecność w neuronach adrenergicznych warunkuje prawidłową aktywność β-hydroksylazy dopaminy (DBH), która przekształca dopaminę w noradrenalinę i jest niezbędna do równowagi katecholamin. W przypadku zaburzeń metabolizmu miedzi równowaga pomiędzy dopaminą a noradrenaliną zostaje zachwiana i wiąże się z wyższym poziomem dopaminy i niskim noradrenaliny w mózgu i w osoczu. Takie zmiany obserwowane są m.in. w genetycznie uwarunkowanej chorobie Menkesa (MNKD) i są wykorzystywane do jej diagnostyki.
W mózgu obecne są również pozostałe enzymy zależne od miedzi, jak ceruloplazmina, oksydaza lizylowa (sieciowanie kolagenu), SOD3, jednak ich rola w OUN nie została jeszcze wyjaśniona.
Oprócz roli kofaktora enzymów, miedź bierze udział w wielu procesach komórkowych, w których pełni rolę regulacyjną i sygnalizacyjną. Jest niezbędna do mielinizacji neuronów, moduluje funkcje receptorów GABA i NMDA, dzięki czemu wpływa na przepływ neurotransmiterów w synapsach. Dlatego przy niedoborze miedzi w diecie obserwuje się zaburzenia metaboliczne, zaburzenia mielinizacji neuronów, drgawki. Szkodliwy jest również nadmiar miedzi. Na przykład w chorobie Wilsona – genetycznie uwarunkowanej chorobie spichrzeniowej – miedź gromadzi się w mózgu i innych tkankach, a wzrost jej poziomu powoduje szerokie spektrum patologii neurologicznych i psychiatrycznych, w tym depresję, epizody psychotyczne, dystonię, drżenie i zaburzenia snu. Zaburzenie równowagi miedzi opisano także w przypadku choroby Parkinsona i Alzheimera, mogą może być również czynnikiem przyczyniającym się do etiologii innych zaburzeń neurodegeneracyjnych i starzenia się.

Wpływ miedzi na płodność u mężczyzn
Miedź odgrywa ważną rolę w męskiej płodności, jest elementem niezbędnym do produkcji męskich gamet oraz w procesach podziału komórek, takich jak mitoza i mejoza.
Enzymy, w których miedź jest kofaktorem (ceruloplazmina, dysmutaza nadtlenkowa SOD1 i SOD2, oksydaza cytochromu C), są również obecne na wszystkich etapach gametogenezy, a ponadto w komórkach somatycznych jąder i najądrzy oraz w płynach związanych z plemnikami w prostacie i najądrzach.
Opisano również udział miedzi w dystrybucji androgenów – męskich hormonów płciowych – na osi podwzgórze – przysadka – jądro.
Stąd zarówno wzrost stężenia miedzi, jak i jej niedobór, prowadzi do zaburzeń płodności. Wpływ miedzi na te procesy nabiera większego znaczenia wobec faktu, iż problem niepłodności dotyczy coraz większej liczby osób, a środowisko jest coraz bardziej zanieczyszczone.
Diagnostyka zawartości miedzi w organizmie człowieka – testy z krwi i z moczu, kiedy zrobić badanie?
Miedź to pierwiastek niezbędny do prawidłowego rozwoju organizmów żywych, poprzez uczestnictwo w bardzo wielu reakcjach enzymatycznych. Dlatego niedobór miedzi w sposób istotny wpływa na redukcję lub całkowite zablokowanie enzymów zależnych od miedzi, hamując w ten sposób niektóre procesy życiowe. Z drugiej strony miedź jako pierwiastek reaktywny może powodować powstawanie wolnych rodników, co w konsekwencji może doprowadzić do uszkodzenia DNA oraz białek. Dlatego organizm człowieka wypracował precyzyjne mechanizmy regulujące stężenie miedzi w komórkach. Przyjmowanie suplementów miedzi i cynku może zaburzać tę równowagę. Miedź powinna być dostarczana z pożywienia.
Stany wymagające ewentualnej suplementacji miedzią obejmują:
- chorobę Menkesa – genetycznie uwarunkowane zaburzenia wchłaniania miedzi,
- zaburzenia wchłaniania związane z celiakią i chorobami trzustki,
- choroby nerek,
- wykryte niedobory miedzi.
Badanie poziomu miedzi w organizmie można wykonać z krwi i z moczu.
Wskazania do wykonania poziomu miedzi w surowicy obejmują:
- podejrzenie choroby Menkesa,
- podejrzenie choroby Wilsona – zaburzenia wbudowywania miedzi do ceruloplazminy,
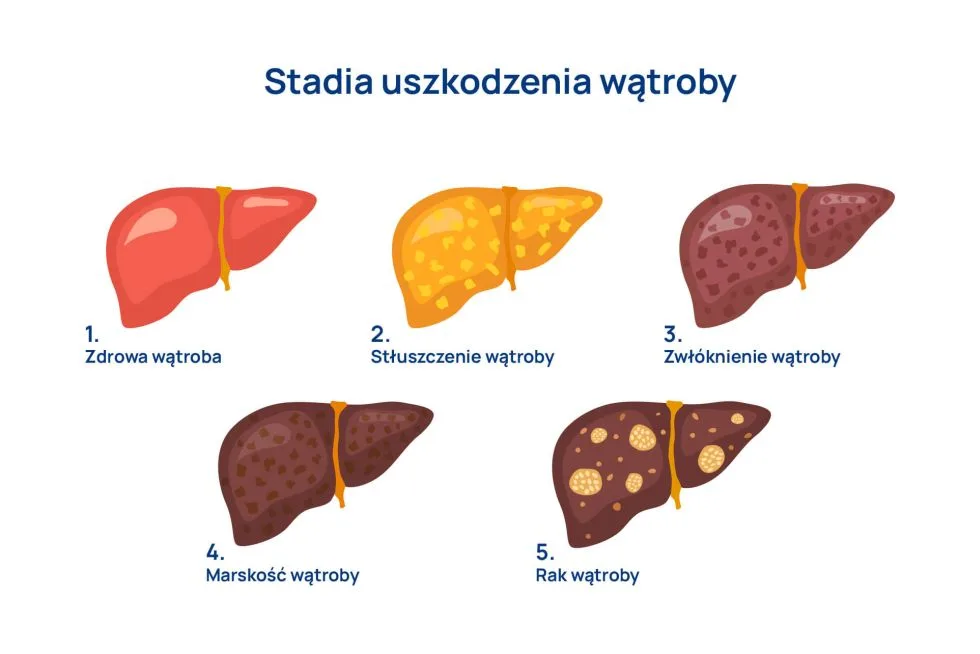
- marskość wątroby,
- podejrzenie niedoborów lub nadmiaru miedzi w organizmie.
Badanie poziomu miedzi w moczu jest badaniem przydatnym w diagnostyce i monitorowaniu choroby Wilsona. Jego przydatność w oznaczaniu poziomu miedzi w organizmie jest ograniczona.
Piśmiennictwo
- Zhou Q, Xue S, Zhang L, Chen G. Trace elements and the thyroid. Front Endocrinol (Lausanne). 2022 Oct 24;13:904889. doi: 10.3389/fendo.2022.904889. PMID: 36353227; PMCID: PMC9637662.
- Liu Y, Miao J. An Emerging Role of Defective Copper Metabolism in Heart Disease. Nutrients. 2022 Feb 7;14(3):700. doi: 10.3390/nu14030700. PMID: 35277059; PMCID: PMC8838622.
- Lutsenko S, Washington-Hughes C, Ralle M, Schmidt K. Copper and the brain noradrenergic system. J Biol Inorg Chem. 2019 Dec;24(8):1179-1188. doi: 10.1007/s00775-019-01737-3. Epub 2019 Nov 5. PMID: 31691104; PMCID: PMC6941745.
- Ogórek M, Gąsior Ł, Pierzchała O, Daszkiewicz R, Lenartowicz M. Role of copper in the process of spermatogenesis. Postepy Hig Med Dosw (Online). 2017 Aug 9;71(0):663-683. doi: 10.5604/01.3001.0010.3846. PMID: 28791960.