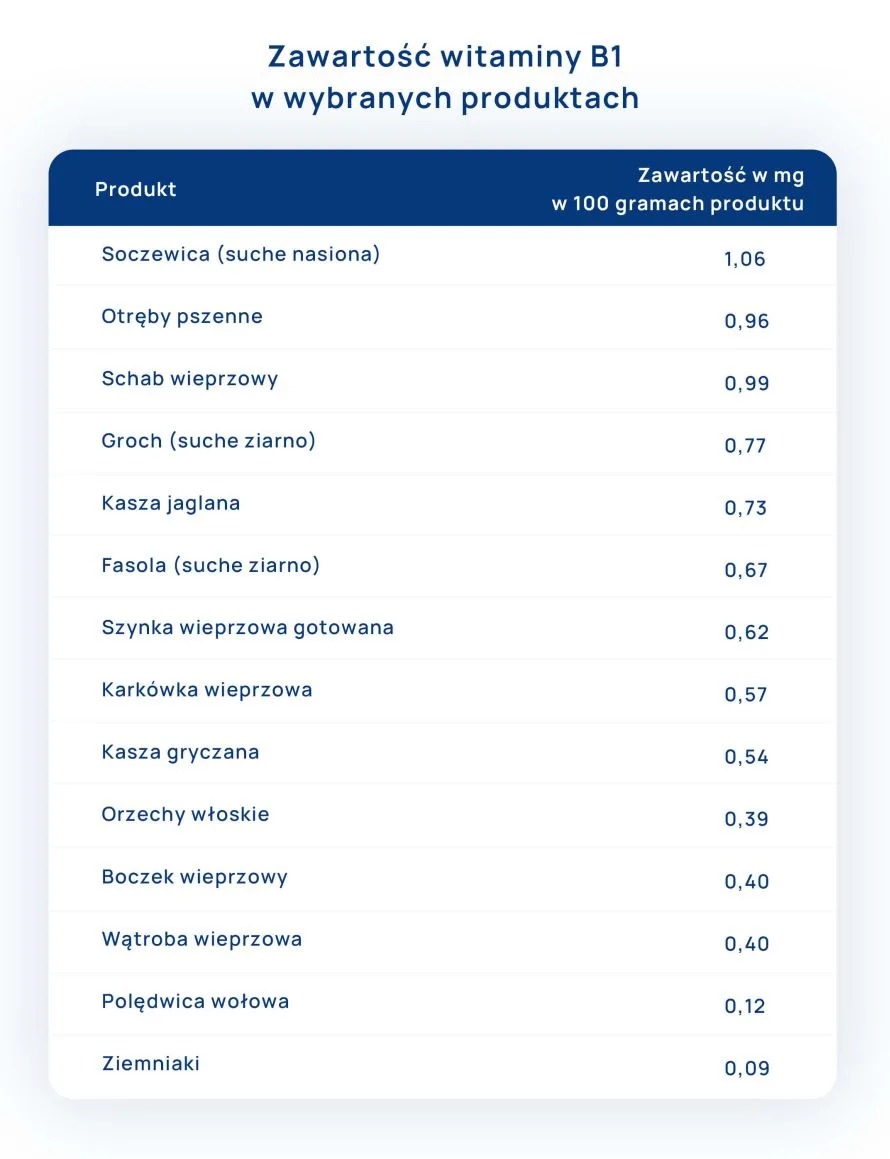
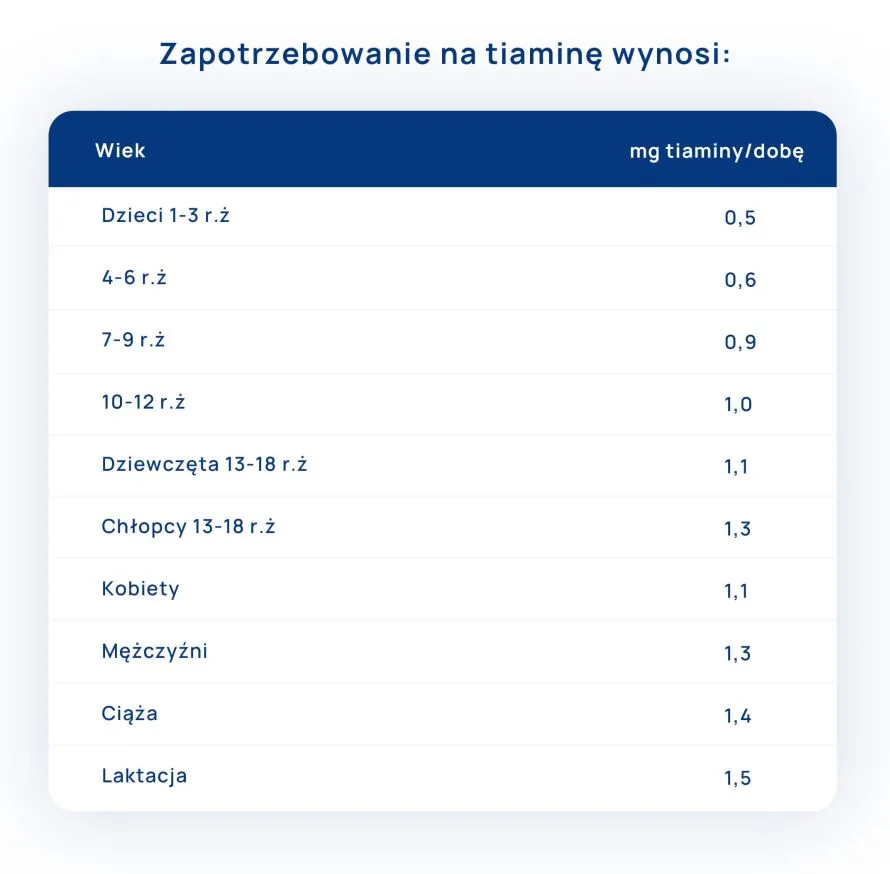
Spis treści
- Cukrzyca typu 2
- Choroby autoimmunologiczne
- Reumatoidalne zapalenie stawów (RZS)
- Stwardnienie rozsiane
- Astma (dychawica)
- Choroby nowotworowe
Otyłość jest definiowana jako stan nieprawidłowej lub nadmiernej akumulacji tkanki tłuszczowej z towarzyszącym przewlekłym stanem zapalnym o niskim nasileniu (low-grade inflammation) znanym również jako meta-zapalenie (meta-inflammation). Częstość występowania otyłości i związanych z nią zaburzeń wzrasta na całym świecie. Wiadomo, że otyłość zwiększa ryzyko rozwoju wielu chorób cywilizacyjnych, w tym miażdżycy, cukrzycy i niektórych nowotworów. Uważa się, że obecność zapalenia metabolicznego u osób otyłych może również predysponować do rozwoju chorób autoimmunizacyjnych oraz alergii. Wynika to z faktu, że meta-zapalenie działa immunomodulująco na komórki układu odpornościowego, przez co wpływa m.in. na równowagę immunologiczną. Dzieje się tak, ponieważ otyłość wiąże się z przewlekłą reakcją zapalną o niskim nasileniu, która charakteryzuje się nieprawidłową produkcją cytokin, zwiększoną syntezą markerów ostrej fazy, takich jak białko C-reaktywne (CRP), oraz aktywacją prozapalnych szlaków sygnałowych.
Metabolizm i odporność są ze sobą ściśle powiązane. Zarówno nadmierne spożycie pokarmów, jak i niedożywienie mają wpływ na funkcjonowanie układu odpornościowego. Głód i niedożywienie mogą osłabić funkcję odpornościową i zwiększyć podatność na infekcje. Otyłość wiąże się ze stanem nieprawidłowej aktywności układu odpornościowego i zwiększonym ryzykiem towarzyszących chorób zapalnych, w tym miażdżycy, cukrzycy, stłuszczenia wątroby, chorób autoimmunizacyjnych, a nawet nowotworów. Zatem optymalna homeostaza żywieniowa i metaboliczna jest ważnym elementem prawidłowego funkcjonowania układu odpornościowego i dobrego zdrowia.
Brak równowagi metabolicznej prowadzi do braku równowagi immunologicznej z głodem i immunosupresją z jednej strony, a otyłością i chorobami zapalnymi z drugiej. Wiele interakcji między układem metabolicznym a układem odpornościowym jest zorganizowanych przez złożoną sieć rozpuszczalnych mediatorów pochodzących z komórek odpornościowych i adipocytów. Oprócz adipocytów, które są najliczniejszym typem komórek w białej tkance tłuszczowej, tkanka tłuszczowa zawiera także preadipocyty (są to adipocyty, które nie zostały jeszcze obciążone lipidami), komórki śródbłonka, fibroblasty, leukocyty i makrofagi.
Makrofagi pochodzą ze szpiku kostnego, a liczba tych komórek obecnych w białej tkance tłuszczowej jest bezpośrednio powiązana z otyłością. W rzeczywistości tkanka tłuszczowa osób otyłych zawiera zdecydowanie większą liczbę makrofagów w porównaniu do osób szczupłych. Zidentyfikowano również pewne cytokiny, takie jak ligand chemokiny CC 2 (CCL2) wytwarzany przez adipocyty, jako potencjalny czynnik przyczyniający się do infiltracji makrofagów do tkanki tłuszczowej. Gdy makrofagi są obecne i aktywne w tkance tłuszczowej, wraz z adipocytami i innymi typami komórek obecnymi w tkance tłuszczowej mogą utrwalić mechanizm ciągłej migracji makrofagów i produkcji cytokin prozapalnych. W rzeczywistości makrofagi w tkance tłuszczowej wydają się być głównym źródłem TNFα, jednakże adipocyty odpowiadają za prawie jedną trzecią stężenia IL-6 w krążeniu pacjentów otyłych. Ponadto również inne produkty tkanki tłuszczowej, takie jak leptyna, stanowią ważny związek między otyłością, insulinoopornością i powiązanymi zaburzeniami zapalnymi.
Cukrzyca typu 2
W patogenezie cukrzycy typu 2 (T2D) współistnieją dwa podstawowe zaburzenia – oporność na insulinę i upośledzenie sekrecji insuliny. Upośledzone działanie obwodowe insuliny związane jest ze zjawiskiem otyłości. Tkanka tłuszczowa uwalnia wolne kwasy tłuszczowe, hormony oraz cytokiny takie jak leptyna, adiponektyna, rezystyna, TNF-α i inne. Wszystkie te cząsteczki modyfikują działanie insuliny. Choroba ta prowadzi do poważnych powikłań wiodących do ślepoty, amputacji kończyn i niewydolności nerek, jest również przyczyną przedwczesnej śmierci głównie sercowo naczyniowej.
Naturalny przebieg cukrzycy typu 2 prowadzi od insulinooporności do kompensacyjnej hiperinsulinemii i dysfunkcji komórek trzustki. Subkliniczny stan zapalny o niewielkim nasileniu może odgrywać ważną rolę w patogenezie związanej z otyłością, insulinoopornością i cukrzycą typu 2 (T2D). Biomarkery stanu zapalnego, takie jak TNF, IL-6 i CRP, są obecne w wyższych stężeniach u osób insulinoopornych i otyłych, a zmniejszoną ekspresję obserwuje się po utracie masy ciała. Markery te mogą również prowadzić do stanu dysfunkcji śródbłonka naczyń i zapalenia naczyń, co sprzyja rozwojowi miażdżycowej choroby układu krążenia. Ponadto insulinooporność może być częściowo przyspieszona przez reakcję ostrej fazy stanowiącą część wrodzonej odpowiedzi immunologicznej, podczas której z tkanki tłuszczowej uwalniane są duże ilości mediatorów prozapalnych. Poziom leptyny w osoczu jest dodatnio skorelowany ze wskaźnikiem masy ciała (BMI), a otyłość jest czynnikiem ryzyka T2D. Związek między leptyną a T2D jest również potwierdzany w badaniach.
Istotną rolę w chorobach metabolicznych pełnią również lipidy. Hiperlipidemia prowadzi do zwiększonego wychwytu kwasów tłuszczowych przez komórki mięśniowe i wytwarzania metabolitów kwasów tłuszczowych, które stymulują kaskady zapalne i hamują sygnalizację insuliny. Z drugiej strony lipidy wewnątrzkomórkowe mogą również działać przeciwzapalnie – ligandy wątrobowego receptora X (LXR) i rodziny jądrowych receptorów hormonalnych to odpowiednio oksysterole i kwasy tłuszczowe, a aktywacja tych czynników transkrypcyjnych hamuje ekspresję genów zapalnych w makrofagach i adipocytach.
Dlatego też lepsze zrozumienie wpływu szlaków sygnalizacyjnych na działanie insuliny stwarza szansę i wyzwanie w zakresie opracowania powiązanych podejść terapeutycznych w celu poprawy wrażliwości na insulinę.
Komórka musi osiągnąć równowagę pomiędzy metabolizmem a stanem zapalnym. W warunkach nadmiernego odżywiania staje się to szczególnym wyzwaniem, ponieważ same procesy wymagane do odpowiedzi na składniki odżywcze i wykorzystanie składników odżywczych, takie jak mitochondrialny metabolizm oksydacyjny i zwiększenie syntezy białek w ER, mogą indukować odpowiedź zapalną.
Choroby autoimmunizacyjne
Częstość występowania chorób autoimmunizacyjnych, takich jak toczeń rumieniowaty układowy (SLE), reumatoidalne zapalenie stawów (RZS), stwardnienie rozsiane (MS) i cukrzyca typu 1 (T1D), wzrasta w krajach zamożnych i jest powiązana ze stężeniem leptyny.

Reumatoidalne zapalenie stawów (RZS)
Stężenie leptyny w surowicy jest wyższe u chorych na RZS z dużą aktywnością choroby, dobrze koreluje z aktywnością choroby i znacznie się zmniejsza, gdy choroba jest dobrze kontrolowana. W reumatoidalnym zapaleniu stawów (RZS) zaburzeniu ulega zarówno odpowiedź immunologiczna nabyta i wrodzona. Stan zapalny pojawia się, gdy komórki układu odpornościowego infiltrują błonę maziową i płyn maziowy. Komórki pojawiające się w nacieku zapalnym to limfocyty T oraz B, plazmocyty, makrofagi, neutrofile i komórki NK. W miejscu infiltracji przez komórki układu odpornościowego dochodzi do uwalniania czynników prozapalnych takich jak TNF-a oraz IL-6, IL-1 i IL-23. Dotychczasowe badania wskazują, że w procesie powstawania reakcji zapalnej w RZS kluczową rolę odgrywają limfocyty Th1 i Th17.
Związek między otyłością i reumatoidalnym zapaleniem stawów (RZS) jest z biologicznego punktu prawdopodobny, ponieważ stan zapalny obecny w tkance tłuszczowej może wpływać na układ immunologiczny całego ustroju. W badaniach wykazano, że zarówno wysoki BMI, jak i otyłość brzuszna u mężczyzn były związane ze wzrostem ryzyka rozwoju RZS. W kolejnym dużym kohortowym badaniu stwierdzono, że ryzyko seropozytywnej i seronegatywnej postaci RZS było podwyższone, szczególnie wśród kobiet, u których choroba wystąpiła wcześnie. Podobne wyniki uzyskano również w innym badaniu z 2012 r., gdzie u otyłych kobiet stwierdzono zwiększone ryzyko rozwoju postaci reumatoidalnego zapalenia stawów (RZS) bez przeciwciał anty-CCP i dodatkowo stwierdzono mniejsze ryzyko wystąpienia seropozytywnego RZS u otyłych mężczyzn. Otyłość może również wpływać na przebieg, leczenie i rokowanie pacjentów. Część dostępnych danych wskazuje na korelację pomiędzy otyłością i stopniem ciężkości choroby. Operacja bariatryczna u takich osób może spowodować spadek aktywności choroby oraz wpływać pozytywnie na proces leczenia RZS.
Zaobserwowano również, że restrykcja kaloryczna (<215 kcal/dzień) przyczynia się do poprawy stanu pacjenta z RZS, co jest związane ze znaczącym obniżeniem poziomu leptyny w surowicy i zmniejszoną całkowitą liczbą limfocytów, zmniejszoną liczbą komórek T CD4+ i T CD8* we krwi oraz wzrostem produkcji IL-4. Wyniki metaanalizy sugerują również, że otyłość i nadwaga wpływają na powodzenie leczenia przeciwreumatycznego, zmniejszając szanse na osiągnięcie stanu minimalnej aktywności choroby oraz wydłużając proces leczenia.
Wysoki poziom leptyny wiąże się także ze zwiększoną podatnością na rozwój choroby zwyrodnieniowej stawów. W rzeczywistości postawiono hipotezę, że zwiększona predyspozycja kobiet do rozwoju choroby zwyrodnieniowej stawów może wynikać z wyższego poziomu leptyny w krążeniu obserwowanym u kobiet w porównaniu z mężczyznami.
Przeprowadzone badania wykazały, że leptyna sprzyja toczniowi rumieniowatemu układowemu (SLE) poprzez zwiększenie produkcji autoprzeciwciał i hamowanie regulacji układu odpornościowego.
Stwardnienie rozsiane
Stwardnienie rozsiane (sclerosis multiplex, SM) jest przewlekłą chorobą układu nerwowego, która dotyka szczególnie młode dorosłe osoby pomiędzy 20. a 40. rokiem życia. Na świecie na stwardnienie rozsiane (SM) cierpi ponad 2,5 miliona ludzi. Badania ostatnich lat wskazują na związek otyłości z rozwojem stwardnienia rozsianego. Wykazano zależność pomiędzy wysokim BMI u młodych dorosłych osób (wiek 18-25) a zwiększonym ryzykiem wystąpienia SM. Zależność taka częściej była obserwowana u kobiet niż u mężczyzn. Również w młodszej grupie wiekowej (11-18 lat) wśród dziewcząt wykazano związek pomiędzy otyłością a wystąpieniem dziecięcej postaci stwardnienia rozsianego (SM) oraz klinicznie izolowanego zespołu (CIS; clinically isolated syndrome). Mechanizm tego zjawiska nadal nie jest poznany. Postuluje się jednak, że może być to związane z niedoborem witaminy D, który towarzyszy otyłości a jest czynnikiem ryzyka rozwoju SM.
Na rozwój oraz przebieg stwardnienia rozsianego (SM) mogą również wpływać czynniki uwalniane z tkanki tłuszczowej m.in. leptyna, visfatyna, rezystyna oraz chemeryna. U pacjentów z SM w fazie zaostrzenia wykazano wyższą ekspresję receptora dla leptyny w komórkach T CD8+ i monocytach w porównaniu do kontroli zdrowej i pacjentów w remisji. Leptyna indukuje komórki Th1 i promuje pro-zapalne środowisko cytokinowe w przebiegu SM. Dodatkowo stwierdzono obniżoną ekspresję czynnika transkrypcyjnego w limfocytach T oraz pozytywną korelację pomiędzy stężeniem leptyny i rezystyny a stężeniem cytokin pro-zapalnych TNF-α oraz IL-13.
Astma
Astma jest przewlekłą chorobą dróg oddechowych, która może pojawić się w każdym wieku. Astma jest chorobą niejednorodną pod względem patomechanizmu oraz obrazu klinicznego. Przy omawianiu astmy często stosuje się podział na astmę Th2-zależną i Th2-niezależną. Większość przypadków stanowi astma Th2-zależna należąca do nadwrażliwości typu I, której towarzyszy eozynofilia. W omawianej reakcji immunologicznej komórkami efektorowymi są limfocyty pomocnicze -Th2, uwalniające IL-4, IL-5 oraz IL-13. W omawianym typie astmy można wyróżnić kilka podtypów takich jak: postać wczesnodziecięca, postać o późnym początku, czy wywołana aktywnością fizyczną. Całkowity poziom IgE, jak również IgE specyficznych jest wyższy w porównaniu do postaci o późnym początku. Astmie rozwijającej się w wieku dojrzałym często towarzyszy eozynofilia (>2%) w wydzielinie dróg oddechowych oraz brak objawów klinicznych alergii. Zwykle obserwuje się niską nadreaktywność oskrzeli oraz rzadziej występuje obciążony wywiad rodzinny.
W typie astmy Th2-niezależnym możemy natomiast wyróżnić: postać o bardzo późnym początku, astmę neutrofilową, oraz astmę związaną z otyłością. Pacjenci z astmą Th2-niezależną charakteryzują się brakiem markerów reakcji Th2-zależnej, słabą odpowiedzią na leczenie kortykosterydami oraz mniejszą obstrukcją i nadreaktywnością dróg oddechowych. Najsilniejszymi czynnikami ryzyka rozwoju astmy są substancje wziewne i cząsteczki, które mogą wywoływać reakcje alergiczne lub podrażniać drogi oddechowe, jednak badania ostatnich lat wykazały, że zarówno u dorosłych, jak i dzieci otyłość stanowi dodatkowy czynnik ryzyka wystąpienia astmy. Osoby dorosłe otyłe z astmą nieatopową, które poddano operacji bariatrycznej, u których zastosowano restrykcję kaloryczną, wykazywały znaczącą poprawę stanu klinicznego. Kolejne badanie wykazało, że operacja bariatryczna obniża nadreaktywność dróg oddechowych u pacjentów z astmą z niskim poziomem IgE, natomiast u pacjentów z wysokim poziomem IgE poprawia spoczynkową mechanikę płuc. Udowodniono również, że bogatotłuszczowa dieta może indukować zapalenie dróg oddechowych poprzez zwiększenie odsetka neutrofilów w wydzielinie.
Choroby nowotworowe
Coraz więcej dowodów wskazuje również, że otyłość jest powiązana z rozwojem i progresją nowotworu. W patogenezie nowotworu wydaje się, że bierze udział zbieżność przewlekłego stanu zapalnego, rozregulowanie sygnalizacji insuliny, zmieniona dostępność lipidów i innych makrocząsteczek, a także zmiany w sygnalizacji adipokin. Leptyna związana z nadmiarem otyłości wpływa na ryzyko, rokowanie i progresję nowotworu. Chociaż podstawowe mechanizmy są nadal niejasne, zarówno leptyna, jak i jej ekspresja i funkcja receptora zostały dodatnio skorelowane z progresją nowotworu w niektórych nowotworach pochodzenia endokrynnego.
Szlaki sygnałowe leptyny regulują ekspresję kilku genów związanych z nowotworami, takich jak cyklina D1, COX-2, VEGF i nasilają kilka procesów prokarcynogennych, w tym angiogenezę, antyapoptozę, proliferację komórek, migrację i transformację mezenchymalną. Przyczynia się to do różnych etapów rozwoju nowotworu, począwszy od aktywności, przeżycia, wzrostu i proliferacji nowotworowych komórek macierzystych, aż po inwazję przerzutową w różnych typach komórek nowotworowych. W kontekście zapalnym leptyna może promować zmiany molekularne zdolne do modulowania zachowania komórek nowotworowych i otaczającego mikrośrodowiska, które obejmują komórki macierzyste nowotworu i tkanki tłuszczowej, adipocyty związane z nowotworem, komórki nowotworu nabłonkowego, fibroblasty, a także komórki odpornościowe. Leptyna moduluje odporność wrodzoną i nabytą poprzez działanie w różnych typach komórek.
W związku z rosnącą epidemią otyłości liczba badań na temat nadmiernej masy ciała i jej skutków stale rośnie. Otyłość stanowi istotny czynnik ryzyka wielu chorób cywilizacyjnych oraz alergicznych i autoimmunizacyjnych. Dodatkowo otyłość może wpływać na przebieg tych chorób oraz proces ich leczenia.
Piśmiennictwo
- Chapman DG, Irvin CG, Kaminsky DA, Forgione PM, Bates JH. et al: Influence of distinct asthma phenotypes on lung function following weight loss in the obese. Respirology. 2014; 19
- Ljung L, Rantapaa-Dahlqvist S: Abdominal obesity, gender and the risk of rheumatoid arthritis – a nested case-control study. Arthritis Res Ther. 2016; 18:
- George MD, Giles JT, Katz PP, England BR, Mikuls TR. et al: Impact of obesity and adiposity on inflammatory markers in patients with rheumatoid arthritis. Arthritis Care Res (Hoboken) 2017; 69:
- A.Pérez-Pérez, F. Sánchez-Jiménez,T. Vilariño-García, V. Sánchez-Margalet: Role of Leptin in Inflammation and Vice Versa, Int. J. Mol. Sci. 2020
- Williams, L., L. Bradley, A. Smith, B. Foxwell: Signal transducer and activator of transcription 3 is the dominant mediator of the anti-inflammatory effects of IL-10 in human macrophages, J. Immunol.2004