Spis treści
- Zasady ogólne diety przy przewlekłej chorobie nerek
- Produkty dozwolone i niedozwolone w przewlekłej chorobie nerek (PChN)
- Przykładowy jadłospis w przewlekłej chorobie nerek (PChN) dla pacjentów bez zaostrzenia choroby
Przewlekła choroba nerek (PChN) to zespół chorobowy charakteryzujący się przewlekłym, nieodwracalnym i postępującym pogorszeniem funkcji nerek. Na skutek zmian chorobowych dochodzi do upośledzenia czynności nerek obejmujących szczególnie kłębuszki nerkowe, cewki oraz otaczającą je tkankę śródmiąższową. Rozwijające się schorzenie przyczynia się do spadku czynnych, prawidłowo funkcjonujących kłębuszków nerkowych. Prowadzi to stopniowo do pogorszenia wszystkich funkcji nerek:
- wydalniczej,
- wydzielniczej,
- metabolicznej.
Od wielu lat obserwuje się ciągły wzrost liczby osób z przewlekłą chorobą nerek (PChN). Z badań przeprowadzonych w Polsce wynika, że PChN w różnych stadiach może występować aż u 16% osób dorosłych. Wzrost ten wynika w dużej mierze z epidemii nadwagi i otyłości, coraz większej liczby chorych z nadciśnieniem tętniczym i cukrzycą. Zaburzenia, które towarzyszą tym schorzeniom, są odpowiedzialne za występowanie wielu uszkodzeń narządowych, w tym również za uszkodzenie miąższu nerek.
Zasady ogólne diety przy przewlekłej chorobie nerek
Podstawową zasadą diety przy przewlekłej niewydolności nerek jest ograniczenie spożycia nabiału, mięsa, ryb oraz warzyw strączkowych. Ograniczamy w diecie lub całkowicie wykluczamy w zaawansowanym stadium choroby PChN białka, potas, fosfor, sód. Kontrolujemy poziom żelaza, aby nie dopuścić do anemii. Regulujemy poziom witamin D oraz witamin rozpuszczalnych w wodzie. Dostarczamy odpowiednią ilość i rodzaj NKT.
- Przy przewlekłej niewydolności nerek należy znacznie ograniczać spożywanie produktów białkowych. Nabiał, ryby, mięso oraz warzywa strączkowe są głównym źródłem białka, a jego nadmiar w organizmie obciąża niewydolne nerki. Podczas trawienia białka powstaje mocznik i kreatynina. Chore nerki nie wydalają mocznika i kreatyniny, przez co nagromadzają się w organizmie, prowadząc do zatrucia – toksemii mocznicowej. Dieta bogata w białko może prowadzić także do białkomoczu.
Ilość białka, jaka powinna znaleźć się w diecie chorego, zależy od poziomu mocznika i kreatyniny w osoczu krwi oraz od przesączania kłębuszkowego (klirensu kreatyniny). Nie należy jednak rezygnować z produktów białkowych. Zalecane są chudy nabiał, konkretny rodzaj ryb i chude mięso. Trzeba też pamiętać, by nie ograniczać ilości spożywanego białka poniżej 20 g dziennie, gdyż może to prowadzić do niedożywienia.
- Codzienna dieta chorego na przewlekłą chorobę nerek (PChN) powinna zawierać oleje roślinne – rzepakowy, lniany – ok. 2 łyżek dziennie oraz ryby morskie. Zawarte w nich nienasycone kwasy tłuszczowe zapobiegają zaburzeniom lipidowym.
- Ograniczamy również spożycie sodu, który zatrzymuje wodę w organizmie, wywołuje zwiększone pragnienie, obrzęki i nadciśnienie. Unikamy wszelkich produktów zawierających sól i glutaminian sodu takich jak konserwy, marynaty, wędliny, przetwory mięsne, produkty wędzone, koncentraty spożywcze z dodatkiem glutaminianu sodu np. kostki rosołowe, zupy i sosy z proszku, jarzynka. Czytamy etykiety, sprawdzamy składy produktu spożywczego.
- U chorych na przewlekłą chorobę nerek (PChN) należy kontrolować i ograniczać podaż potasu. Pierwiastek ten w większości jest usuwany przez nerki, gdy dochodzi do utraty przynajmniej 50% funkcji nerek, może rozwinąć się hiperkalemia (wysoki poziom potasu we krwi). Stan ten jest bardzo niebezpieczny, bo doprowadza do zaburzeń rytmu serca, które mogą doprowadzić do nagłego zgonu. Dlatego też, dla bezpieczeństwa, w postępującej PChN, kontroluje się poziom tego pierwiastka i w razie potrzeby wprowadza jego restrykcje. W stopniu 4 i 5 choroby PChN istnieje już konieczność wprowadzenia ograniczenia dostarczania potasu wraz z pożywieniem. W tym celu ogranicza się podaż produktów, które są bogate w ten pierwiastek, czy też stosuje się odpowiednią obróbkę kulinarną, w celu zmniejszenia jego zawartości w diecie.
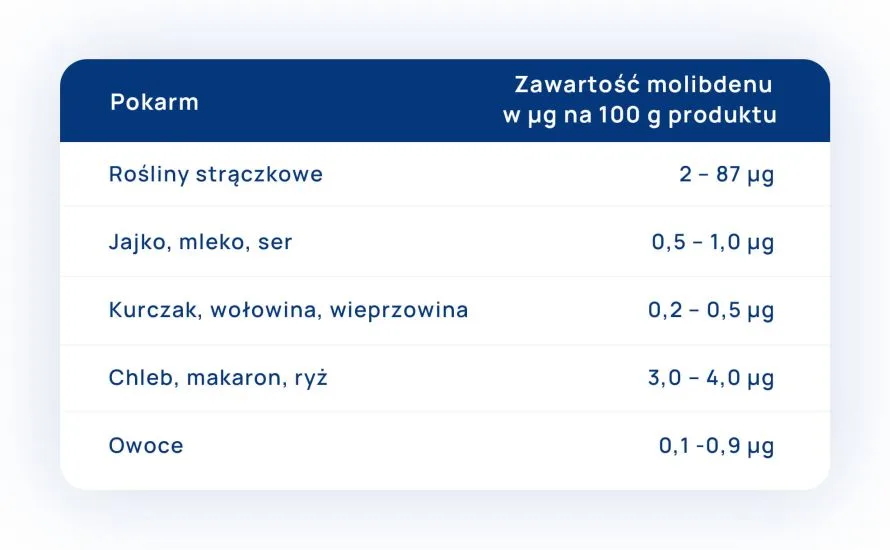
- U chorych z przewlekłą chorobą nerek (PChN), utrudnione jest wydalanie fosforu, dlatego nadmierne jego ilości mogą się gromadzić w połączeniu z wapniem w sercu, mięśniach i naczyniach krwionośnych, co może prowadzić do odwapnienia i osteoporozy. Unikamy jedzenia produktów zawierających duże ilości fosforu – takich jak – sery żółte, topione, żółtko jaja, mleko, mięso, podroby, rośliny strączkowe, kakao i czekolada.
- U pacjentów z przewlekłą chorobą nerek (PChN) często występują niedobory żelaza, może to prowadzić do niedokrwistości.
- Wraz z postępem przewlekłej choroby nerek (PChN), zwiększa się ryzyko niedoborów witaminowych. Najczęściej jest to związane z brakiem apetytu, prowadzoną farmakoterapią czy zaburzeniami wchłaniania, dializoterapią. W szczególności dochodzi do niedoborów witaminy D3, której synteza kończy się właśnie w nerkach, pod wpływem enzymów, które ją przekształcają do formy aktywnej, wykorzystywanej przez nasz organizm. Niedobór tej witaminy upośledza wchłanianie wapnia w organizmie, rozwija się wtórna nadczynność przytarczyc (gruczoły te odpowiadają za gospodarkę wapniowo-fosforanową) i rozwija się osteodystrofia nerkowa (wapń zostaje „wypłukiwany” z kości, przez co dochodzi do osłabienia ich struktury, a związki wapnia osadzają się w tkankach, m.in. w naczyniach krwionośnych, doprowadzając do ich zwapnienia). Wówczas konieczna jest suplementacja tej witaminy, w indywidualnie określonej dawce. Często dochodzi również do niedoborów witamin rozpuszczalnych w wodzie, a zwłaszcza witaminy B6, kwasu foliowego i witaminy C, które należy wtedy suplementować. W końcowych stadiach PChN konieczna jest również suplementacja pozostałych witamin z tej grupy, ze względu na ścisłe restrykcje dietetyczne.
U chorych na przewlekłą chorobę nerek (PChN), dietę różnicujemy ze względu na stopień zaawansowania choroby:
- tradycyjna dieta może być stosowana w pierwszym okresie choroby przy niewydolności utajonej, wtedy nie ograniczamy drastycznie produktów spożywczych, także soli;
- w drugim okresie przy niewydolności wyrównanej należy ograniczać spożycie białka do 35-55g dziennie oraz produkty zawierające fosfor. Tu także nie trzeba drastycznie ograniczać soli kuchennej, zaleca się suplementowanie witaminy D, która ułatwia przyswajanie wapnia;
- w trzecim okresie przy niewydolności niewyrównanej należy jeść ok. 30 g białka dziennie, ograniczać ilość sodu i potasu. Dieta powinna składać się z wysokokalorycznych, ubogobiałkowych produktów spożywczych. Dietę należy wzbogacać suplementami pod kontrolą lekarza lub dietetyka.
- w czwartym i piątym okresie przy niewydolności schyłkowej należy ograniczać ilość białka do ok. 30 g dziennie, nie mniej niż 20 g, gdyż może to doprowadzić do wycieńczenia organizmu. Praktycznie wykluczamy spożycie sodu, fosforu, potasu i ograniczamy spożycie płynów. Jadłospis wzbogacamy w aminokwasy egzogenne w ilości 15-20 g na dobę. W 5 fazie konieczne jest dializowanie, a także może być niezbędny przeszczep nerki.
Produkty dozwolone i niedozwolone w przewlekłej chorobie nerek (PChN)

Przykładowy jadłospis w przewlekłej chorobie nerek (PChN) dla pacjentów bez zaostrzenia choroby
U osób z niewydolnością nerek konieczne jest indywidualne podejście do każdego pacjenta i ustalenie spersonalizowanej diety. Jakość i ilości produktów w diecie dopasowuje się do stanu nerek i ich niewydolności u każdego pacjenta osobno.
Dieta osób z PChN musi nie tylko dostarczać odpowiedniej ilości energii i makroskładników odżywczych, powinna być odpowiednio zbilansowana pod względem zawartości witamin i składników mineralnych. W diecie trzeba kontrolować odpowiednią podaż białek, tłuszczów i węglowodanów, co wiąże się ze ścisłą obserwacją wyników badań Pacjenta, jest to możliwe tylko w przypadku ścisłej współpracy na linii pacjent – lekarz – dietetyk.
I śniadania
a) kasza manna ugotowana na wodzie do tego brzoskwinia lub jabłko, jogurt naturalny
b) chleb wiejski z wędliną z indyka plus papryka czerwona
II śniadania
a) koktajl ze szpinaku i mango z dodatkiem kefiru
b) makaron ryżowy z serem twarogowym półtłustym, truskawkami, cynamonem z odrobiną miodu
Obiad
a) łosoś pieczony w piekarniku do tego ziemniaki z wody i mizeria z zielonego ogórka i jogurtu naturalnego 2%
b) pierś z indyka z ryżem białym/jaśminowym i surówka z sałaty, z pomidorem i papryką z dodatku soku z cytryny i łyżeczki oleju rzepakowego oraz koperku suszonego
Podwieczorek
a) kisiel własnej roboty z mąki pszennej i owoców (maliny/mango/truskawki)
b) pieczone warzywa burak i marchew, posypane ulubionymi ziołami i pokropione olejem rzepakowym.
Kolacja
a) chleb niskobiałkowy, do tego wędlina własnej roboty z udźca indyka, sałata i pomidor.
b) chleb żytni jasny, do tego podany na zimno, uprzednio upieczony filet z dorsza/łososia posypany odrobiną soli, dozwolonych ziół np. koperkiem i kilkoma kroplami cytryny i oleju rzepakowego. Do tego ogórek gruntowy.
Piśmiennictwo
- Włodarek D., Lange E., Kozłowska L., Głąbska D., Dietoterapia. Wydawnictwo Lekarskie PZWL, Warszawa 2014
- H. Ciborowska, A. Rudnicka, Dietetyka. Żywienie Zdrowego i Chorego Człowieka, Wydawnictwo PZWL, Warszawa 2009.
- M. Krasnicka, W. Sulowicz, Rola żywienia w przewlekłej chorobie nerek, „Dietetyka. Oficjalne Czasopismo Polskiego Towarzystwa Dietetyki”, 2018.
- Prof. Dr Hab. N. Med. Mirosław Jarosz Praktyczny podręcznik Dietetyki.