Zapłodnienie in vitro (IVF) to jedna z najskuteczniejszych metod leczenia niepłodności, umożliwiająca wielu parom spełnienie marzenia o rodzicielstwie. W niniejszym artykule przybliżymy, na czym polega procedura in vitro, jakie są jej rodzaje, wskazania oraz przeciwwskazania do jej przeprowadzenia, a także omówimy etapy zabiegu i kwestie związane z wiekiem pacjentek. Zachęcamy do lektury, aby dowiedzieć się więcej o tej zaawansowanej metodzie leczenia niepłodności.
Spis treści:
- Na czym polega in vitro?
- In vitro: wskazania do zabiegu
- In vitro: przebieg i etapy zapłodnienia pozaustrojowego
- Jak przygotować się do zabiegu in vitro?
- Przeciwwskazania do in vitro
Na czym polega in vitro?
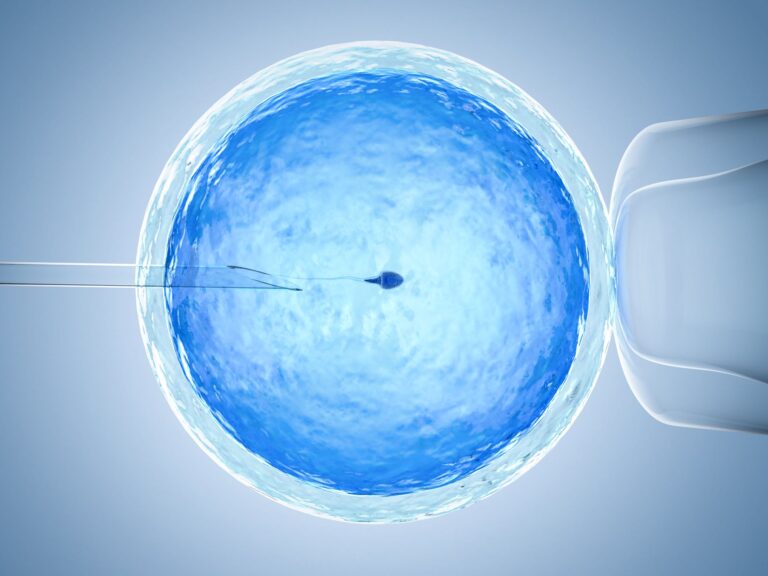
In vitro, czyli zapłodnienie pozaustrojowe, polega na połączeniu komórki jajowej z plemnikiem w warunkach laboratoryjnych, poza organizmem kobiety. Po uzyskaniu zarodka, jest on przenoszony do macicy, gdzie może się zagnieździć i rozwijać, prowadząc do ciąży. Procedura ta omija niektóre przyczyny niepłodności, takie jak niedrożność jajowodów czy zaburzenia owulacji, zwiększając szanse na posiadanie potomstwa.

Rodzaje in vitro
W zależności od indywidualnych potrzeb pacjentów, stosuje się różne techniki zapłodnienia in vitro:
- Klasyczne IVF: Plemniki i komórki jajowe umieszczane są razem w specjalnym medium, gdzie dochodzi do samoistnego zapłodnienia.
- ICSI (Intracytoplasmic Sperm Injection): Polega na wstrzyknięciu pojedynczego plemnika bezpośrednio do komórki jajowej. Metoda ta jest stosowana w przypadku niskiej liczby plemników, ich słabej ruchliwości lub nieprawidłowej budowy.
>> Sprawdź: Plemnik – budowa i funkcje. Jak długo żyją plemniki?
In vitro: wskazania do zabiegu
Zapłodnienie in vitro jest zalecane w sytuacjach, gdy inne metody leczenia niepłodności okazały się nieskuteczne lub nie mają zastosowania. Do głównych wskazań należą:
- Niedrożność lub brak jajowodów: uniemożliwiające naturalne zapłodnienie.
- Endometrioza: szczególnie w III i IV stopniu zaawansowania; zwłaszcza, gdy towarzyszy jej zmniejszona rezerwa jajnikowa lub nieprawidłowości jajowodów.
- Zaburzenia owulacji: niereagujące na leczenie farmakologiczne.
- Czynnik męski: obniżona liczba, ruchliwość lub morfologia plemników.
- Niepłodność idiopatyczna: o nieznanej przyczynie, trwająca dłużej niż rok.
- Niepowodzenia inseminacji domacicznej: szczególnie po 6 nieudanych próbach u kobiet poniżej 35. roku życia lub 4 próbach u kobiet powyżej 35. roku życia.
>> Przeczytaj: Niepłodność u mężczyzn: najczęstsze przyczyny, objawy i rozpoznanie. Leczenie niepłodności
In vitro: przebieg i etapy zapłodnienia pozaustrojowego
Procedura in vitro składa się z kilku kluczowych etapów:
- Stymulacja hormonalna
Kobieta przyjmuje leki hormonalne, które pobudzają jajniki do produkcji większej liczby komórek jajowych.
- Punkcja jajników
Gdy pęcherzyki osiągną odpowiednią wielkość, przeprowadza się zabieg pobrania komórek jajowych pod kontrolą USG, w znieczuleniu ogólnym.
- Pobranie nasienia
Partner oddaje nasienie, które jest następnie przygotowywane w laboratorium.
- Zapłodnienie
Komórki jajowe łączone są z plemnikami w warunkach laboratoryjnych (klasyczne IVF) lub poprzez wstrzyknięcie plemnika do komórki jajowej (ICSI).
- Kulturyzacja zarodków
Powstałe zarodki hodowane są w inkubatorze przez kilka dni, aby ocenić ich rozwój.
- Transfer zarodka
Najlepiej rokujący zarodek przenoszony jest do macicy kobiety, gdzie może się zagnieździć i rozwijać.
- Wsparcie fazy lutealnej
Po transferze pacjentka otrzymuje leki wspomagające implantację zarodka i utrzymanie ciąży.
| Pamiętaj: Cała procedura zapłodnienia in vitro wymaga ścisłej współpracy z lekarzem oraz regularnych badań kontrolnych. |
Jak przygotować się do zabiegu in vitro?
Przygotowanie do in vitro obejmuje zarówno aspekty medyczne, jak i styl życia:
- Konsultacja lekarska: omówienie historii medycznej, wcześniejszych prób leczenia oraz planu działania.
- Badania diagnostyczne: obejmują m.in. badania hormonalne, wirusologiczne, genetyczne oraz ocenę rezerwy jajnikowej.
- Styl życia: zaleca się zdrową dietę, regularną aktywność fizyczną, unikanie stresu oraz rezygnację z używek, takich jak alkohol i papierosy.
- Wsparcie psychologiczne: proces in vitro może być stresujący, dlatego warto skorzystać z pomocy psychologa lub grup wsparcia. Redukcja stresu i pozytywne nastawienie mogą korzystnie wpłynąć na wyniki leczenia.

Rola badań przy in vitro
Przed przystąpieniem do in vitro konieczne jest wykonanie badań diagnostycznych, takich jak:
- badania hormonalne (AMH, FSH, LH, estradiol),
- badania wirusologiczne (HIV, HCV, HBV, kiła),
- badania genetyczne,
- ocena rezerwy jajnikowej,
- badanie nasienia partnera.
Regularne badania kontrolne pozwalają ocenić skuteczność procedury i wybrać optymalną metodę leczenia niepłodności.
>> Zobacz też: Badania laboratoryjne w diagnostyce niepłodności
Przeciwwskazania do in vitro
Nie każda para może poddać się zabiegowi zapłodnienia pozaustrojowego. Do przeciwwskazań należą:
- Choroby nowotworowe – szczególnie te, które wymagają intensywnej terapii przeciwnowotworowej.
- Zaawansowane choroby sercowo-naczyniowe – mogą stanowić zagrożenie dla zdrowia matki i dziecka.
- Ciężkie zaburzenia hormonalne – mogą negatywnie wpływać na skuteczność procedury.
- Nieodpowiednia rezerwa jajnikowa – w niektórych przypadkach rezerwa jajnikowa jest tak niska, że szanse na powodzenie procedury są minimalne.
- Poważne schorzenia psychiczne – jeśli mogą uniemożliwiać odpowiedzialne macierzyństwo.

In vitro: do jakiego wieku można wykonać?
Granica wiekowa dla zabiegu in vitro zależy od wielu czynników, m.in. od kraju, w którym przeprowadza się leczenie. W Polsce większość klinik przyjmuje pacjentki do 42-45. roku życia, jednak decyzja jest indywidualna i zależy od wyników badań. U starszych kobiet często stosuje się komórki jajowe dawczyni, co zwiększa szanse na sukces.
>> Zobacz: Ciąża geriatryczna – co to jest i kiedy o niej mówimy? Jakie badania zrobić przed późną ciążą?
Które choroby wykluczają in vitro?
Niektóre choroby mogą uniemożliwić przeprowadzenie in vitro lub znacząco obniżyć jego skuteczność. Należą do nich:
- Poważne nieprawidłowości anatomiczne w macicy (np. wrodzone wady, znaczne blizny po operacjach, nieprawidłowy kształt) – IVF może być trudne, a w niektórych przypadkach niewskazane.
- Niektóre choroby genetyczne – zwiększające ryzyko przeniesienia wad wrodzonych na dziecko.
- Ciężkie choroby autoimmunologiczne – mogą powodować odrzucenie zarodka przez organizm matki.
- Przewlekłe choroby wątroby i nerek – mogą negatywnie wpływać na przebieg ciąży.
>> To może Cię zainteresować: APS jako przyczyna poronień i niepłodności
Zapłodnienie in vitro to skuteczna metoda leczenia niepłodności, dająca wielu parom szansę na potomstwo. Choć procedura wymaga odpowiedniego przygotowania i może być wymagająca emocjonalnie, nowoczesna medycyna oferuje coraz lepsze sposoby na zwiększenie skuteczności zabiegu. Jeśli rozważasz in vitro, skonsultuj się ze specjalistą, aby ocenić swoje szanse i podjąć najlepsze decyzje.
Bibliografia
- Kuczyński W. i wsp., „Rekomendacje dotyczące diagnostyki i leczenia niepłodności – skrót”. Ginekologia Polska, 2012.
- Łukaszuk K. i wsp., „Diagnostyka i leczenie niepłodności — rekomendacje Polskiego Towarzystwa Medycyny Rozrodu i Embriologii (PTMRiE) oraz Polskiego Towarzystwa Ginekologów i Położników (PTGP)”, Ginekologia i Perinatologia Praktyczna, 2018
- Shingshetty L. i wsp., „Predictors of success after in vitro fertilization”, Fertility and Sterility, 2024.