Artykuł został zaktualizowany 10.02.2025 r.
Spis treści
- Czym jest wirus RSV?
- Jak przenosi się zakażenie RSV?
- Zakażenia RSV w Polsce
- RSV – objawy zakażenia
- Objawy zakażenia u niemowląt
- Objawy zakażenia u dorosłych
- Diagnostyka laboratoryjna w kierunku RSV
- Infekcja RSV – leczenie
- Profilaktyka zakażeń RSV
Wirus RSV jest częstą przyczyną sezonowych zakażeń układu oddechowego. Zakażenie jest szczególnie niebezpieczne dla niemowląt i małych dzieci, u których infekcja może mieć ciężki przebieg. Szacuje się, że RSV odpowiada za 70% infekcji dróg oddechowych u dzieci w pierwszym roku życia.
Czym jest wirus RSV?
Wirus RSV (syncytialny wirus oddechowy, ang. Respiratory Syncytial Virus) należy do pneumowirusów wywołujących schorzenia układu oddechowego. Materiałem genetycznym wirusa jest RNA. Charakterystyczna dla syncytialnego wirusa oddechowego jest zdolność do wywoływania fuzji zakażonych komórek nabłonka wyściełającego drogi oddechowe, prowadząca do powstawania dużych wielojądrowych tworów tzw. syncytiów.
Jak przenosi się zakażenie RSV?
Wirus RSV występuje powszechnie na całym świecie, infekcja dotyczy wyłącznie ludzi. Zakażenia RSV cechuje sezonowość – w Polsce do infekcji dochodzi w okresie od jesieni do wiosny, ze szczytem zachorowań w styczniu i lutym.
Wirus RSV rozprzestrzenia się:
- drogą kropelkową – w trakcie kichania, kasłania
- drogą kontaktową – poprzez przedmioty i ręce
Syncytialny wirus oddechowy jest bardzo zakaźny. Źródłem infekcji jest osoba zakażona, zarówno z objawami chorobowymi, jak i osoba bezobjawowa. Ryzyko zakażenia dotyczy wszystkich grup wiekowych: niemowląt, dzieci i dorosłych. Rozprzestrzenianiu infekcji sprzyja przebywanie w dużych skupiskach ludzi (żłobki, przedszkola, szkoły, internaty, domy opieki długoterminowej i inne).
Zakażenia RSV w Polsce
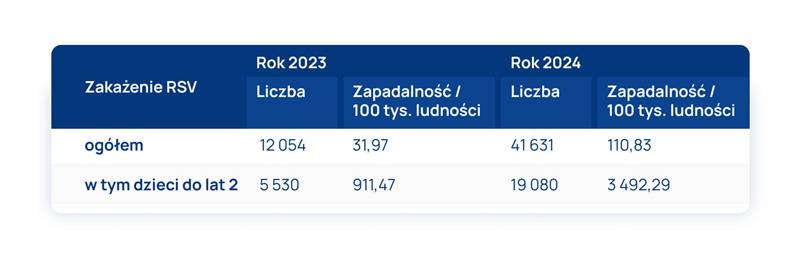
Zakażenia RSV od 24.02.2023r. podlegają w Polsce obowiązkowej rejestracji. Liczba zgłoszonych przypadków podawana jest w meldunkach epidemiologicznych przez Zakład Epidemiologii Chorób Zakaźnych i Nadzoru NIZP-PZH. W roku 2024 zanotowano blisko 3,5- krotny wzrost zachorowań w stosunku do roku 2023. 45% przypadków występuje u dzieci do lat 2-ch.
RSV – objawy zakażenia
Infekcje RSV w sezonie epidemicznym są bardzo częste i mogą przebiegać bezobjawowo, pod postacią „zwykłego przeziębienia” lub mogą prowadzić do zapalenia dolnych dróg oddechowych. Okres wylęgania choroby wynosi 2-8 dni (zazwyczaj 4-6 dni). Wystąpienie objawów jest następstwem odpowiedzi immunologicznej gospodarza, w trakcie której dochodzi do uszkodzenia zakażonych komórek nabłonka.

RSV – czynniki ryzyka ciężkiego przebiegu zakażenia RSV:
- wcześniactwo,
- niemowlęctwo (wiek poniżej 12 m.ż.),
- przewlekłe choroby płuc,
- choroby układu sercowo-naczyniowego,
- wiek powyżej 60 lat,
- umiarkowany lub ciężki niedobór odporności.
Objawy zakażenia u niemowląt
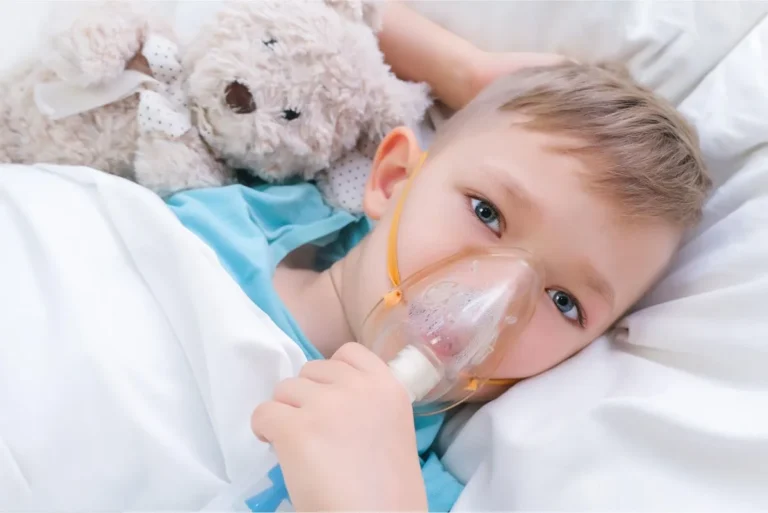
Do pierwotnej infekcji wirusem RSV dochodzi praktycznie u każdego człowieka do 2 roku życia – u 95% 2-latków wykrywane są przeciwciała przeciwko wirusowi. Pierwsze zakażenie wirusem przebiega zazwyczaj objawowo. Pojawia się katar, obrzęk śluzówek nosa, zapalenie spojówek, gorączka, rzadziej zapalenia gardła. Objawy ustępują w ciągu tygodnia lub infekcja rozszerza się na dolne drogi oddechowe. RSV jest głównym czynnikiem martwiczego ostrego zakażenia dróg oddechowych niemowląt i małych dzieci. Przyczyną ciężkiego przebiegu zakażenia w tej grupie wiekowej jest blokowanie wąskich dróg oddechowych przez złogi (śluz, tkanka martwicza) powstające na skutek uszkodzenia zakażonych komórek nabłonka wyściełającego oskrzela i oskrzeliki. Do charakterystycznych objawów zapalenia dolnych dróg oddechowych należą: trudności w oddychaniu, kaszel, świszczący oddech, trudności z karmieniem, bezdech, odwodnienie. Wymienione objawy powinny skłonić rodziców do wizyty w szpitalu, ponieważ infekcja może prowadzić do zagrożenia życia niemowląt i konieczna może okazać się hospitalizacja. U starszych dzieci zakażenie może przebiegać bezobjawowo lub pod postacią pospolitego przeziębienia, rzadziej następstwem jest zapalenie oskrzeli lub płuc.
Objawy zakażenia u dorosłych
U dorosłych zakażenie wirusem RSV przebiega zazwyczaj łagodnie, powodując objawy ze strony górnych dróg oddechowych. Do najczęstszych objawów należą: katar, kaszel, obrzęk śluzówek nosa, ból głowy, ogólne rozbicie, brak apetytu. Zakażenie może przebiegać również bezobjawowo, ale warto pamiętać, że osoba zainfekowana, niezależnie od występowania lub braku objawów, jest zakaźna dla otoczenia. Powikłania u dorosłych w postaci zapalenia oskrzeli lub zapalenia płuc dotyczą osób z grupy ryzyka ciężkiego przebiegu zakażenia RSV, co związane jest z wiekiem (> 60 lat) oraz występowaniem chorób przewlekłych.
UWAGA: przebycie zakażenia wirusem RSV nie daje trwałej odporności, ale kolejna infekcja przebiega zazwyczaj łagodniej.
Diagnostyka laboratoryjna w kierunku RSV
Objawy kliniczne występujące w przebiegu zakażenia wirusem RSV są niespecyficzne i mogą występować również w trakcie infekcji innymi wirusami i bakteriami. Potwierdzenie zakażenia RSV uzyskuje się w oparciu o testy laboratoryjne: genetyczne i antygenowe. Próbką do badania jest materiał pobrany z górnych lub dolnych dróg oddechowych. Testy serologiczne wykonywane z krwi służą do wykrywania przeciwciał przeciwko wirusowi RSV.
Rodzaje testów stosowanych w diagnostyce RSV
- Testy molekularne (genetyczne)
Najbardziej wiarygodnym badaniem w kierunku wirusa RSV jest test genetyczny. Powszechnie stosowana metoda rRT– PCR (ang. Real-time reverse transcription-polymerase chain reaction) jest bardzo czuła i specyficzna. Test można wykonywać jako badanie ukierunkowane na jeden patogen lub wykrywanie materiału genetycznego wirusa RSV może być składową testu multipleksowego, obejmującego również inne drobnoustroje, które mogą być przyczyną objawów chorobowych ze strony układu oddechowego.

- Testy antygenowe
Testy antygenowe wykrywają białka charakterystyczne dla wirusa RSV. Możliwe jest wykonanie badania ukierunkowanego lub badania wykrywającego jednoczasowo antygeny dla kilku różnych patogenów układu oddechowego. Testy antygenowe mają wysoką czułość u małych dzieci, są mniej czułe u starszych dzieci i dorosłych.

- Hodowla
Badanie nie jest stosowane rutynowo, ma znaczenie dla celów naukowych
- Badania serologiczne
Testy wykonywane są z krwi wykrywają przeciwciała przeciwko wirusowi RSV. Badanie ma znaczenie dla nadzoru epidemiologicznego.
Infekcja RSV – leczenie
Nie istnieje leczenie przyczynowe zakażeń RSV. Podstawą jest leczenie objawowe i wspomagające. Noworodki i niemowlęta powinny być zbadane przez lekarza, który zaleci odpowiednią terapię. Niezwykle istotne jest prawidłowe oczyszczanie nosa z wydzieliny. Czynność tą wykonują rodzice przy pomocy specjalnych aspiratorów, ponieważ małe dzieci nie potrafią same wydmuchiwać nosa. Do czyszczenia i rozrzedzania wydzieliny można stosować roztwór soli morskiej. Prawidłowe oczyszczanie nosa zapobiega rozszerzaniu się infekcji z górnych na dolne drogi oddechowe.
W trakcie leczenia starszych dzieci i dorosłych ważny jest odpoczynek, oczyszczanie nosa, odpowiednia dieta oraz preparaty obniżające temperaturę, zmniejszające obrzęk błony śluzowej nosa, zmniejszające ból gardła. W przypadku przedłużających się objawów należy skontaktować się z lekarzem.


Profilaktyka zakażeń RSV
Pierwsza dostępna na polskim rynku szczepionka przeciwko RSV, zarejestrowana w lipcu 2023 r., zalecana jest dla osób powyżej 60. roku życia. W chwili obecnej nie ma żadnej skutecznej szczepionki przeciwko wirusowi RSV dla dzieci. Dzieciom z grup ryzyka podawane są gotowe przeciwciała przeciwko wirusowi w ramach programu zapobiegania ciężkim zachorowaniom wywołanym przez RSV, realizowanego w Polsce od 2008 roku.
W przypadku wszystkich osób, niezależnie od wieku i przynależności do grupy ryzyka, niezwykle istotna jest profilaktyka nieswoista, która obejmuje:
- dbanie o higienę rąk,
- izolację od osób zakażonych,
- unikanie przebywania w dużych skupiskach ludzi w okresie epidemicznym,
- wietrzenie pomieszczeń.
Piśmiennictwo
- Patric R. Murray, K.S. Rozenthal, M.A.Pfaller – Mikrobiologia wyd.VI Wrocław 2011
- Centers for Disease Control and Prevention – Respiratory Syncytial Virus Infection (RSV) https://www.cdc.gov/rsv/clinical/index.html (dostęp 15.11.2023 r.)
- dr n. med. Ewa Duszczyk – Zakażenia RSV – objawy, leczenie, powikłania (18.04.2023)
- https://www.mp.pl/pacjent/choroby-zakazne/choroby/zakazenia-wirusowe/321332,zakazenia-rsv-objawy-leczenie-powiklania
- dr n. med. Jacek Mrukowicz, Małgorzata Ściubisz – Jakie są czynniki ryzyka ciężkiego przebiegu zakażenia wirusem syncytium nabłonka oddechowego (RSV) u osób dorosłych i hospitalizacji z tego powodu? (12.10.2023) https://infekcje.mp.pl/choroby/rsv/333251,jakie-sa-czynniki-ryzyka-ciezkiego-przebiegu-zakazenia-wirusem-rsv-u-osob-doroslych-i-hospitalizacji-z-tego-powodu?postlogin=
- https://wwwold.pzh.gov.pl/oldpage/epimeld/2024/INF_24_12B.pdf