Spis treści
- Udar mózgu – ogólne informacje
- Produkty zalecane i przeciwwskazane w diecie po udarze mózgu
- Przykłady diety po udarze mózgu
Udar mózgu stanowi w Polsce trzecią co do częstości przyczynę zgonów oraz najczęstszy powód trwałej niesprawności u osób powyżej 40 roku życia. Rocznie odnotowuje się ponad 60 tysięcy udarów mózgu. Choć ich przebieg i rokowania są różne, to w przypadku prawie każdego pacjenta odpowiednia dieta może odgrywać istotną rolę podczas powrotu do zdrowia.
Udar mózgu – ogólne informacje
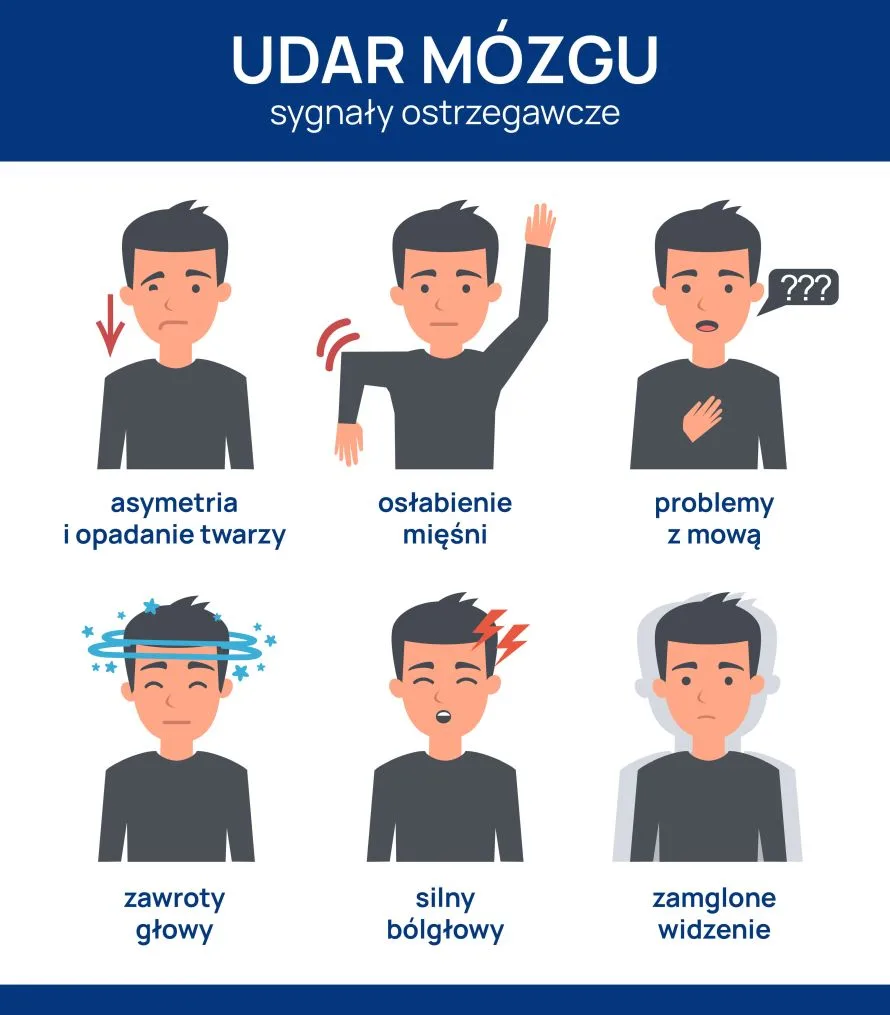
Udarem mózgu nazywa się nagle występujące objawy uszkodzenia mózgu takie jak:
- niedowład,
- utrata zdolności rozumienia,
- utrata zdolności mówienia,
- niedowidzenie,
- utraty przytomności w udarze krwotocznym,
- bólu głowy, nudności czy wymioty u chorych przytomnych.
Powyższe objawy są wynikiem zaburzenia krążenia krwi w mózgu, są uzależnione od miejsca i rozległości uszkodzenia mózgu.
Rozróżniamy udar mózgu:
- krwotoczny – krwotok śródmózgowy, krwotok podpajęczynówkowy,
- niedokrwienny, czyli zawał.
Najczęstszą przyczyną udaru krwotocznego śródmózgowego jest nadciśnienie tętnicze.
Natomiast udaru podpajęczynówkowego – pękniecie tętniaka, naczyniaka, uraz głowy, skaza krwotoczna.
Istotnymi czynnikami ryzyka udaru mózgu są:
- otyłość,
- dieta bogata w tłuszcze zwierzęce,
- palenie papierosów,
- alkoholizm,
- brak aktywności fizycznej.
Co jest istotne to fakt, że ryzyko niedożywienia po udarze mózgu dotyczy ponad 60% pacjentów. Odsetek niedożywionych pacjentów po ostrym udarze mózgu zwiększa się z 9% do 65% już w ciągu 10 dni hospitalizacji. Istnieje wiele potencjalnych czynników sprzyjających rozwojowi niedożywienia. Głównym z nich są zaburzenia połykania, tzw. dysfagia, występująca u 64-78% pacjentów po udarze mózgu. Należy również podkreślić, że ostry udar mózgu jest chorobą zwiększającą zapotrzebowanie na energię i nasilającą m.in. utratę masy mięśniowej. Co więcej, pacjenci bardzo często zmagają się także z różnymi ograniczeniami w codziennym funkcjonowaniu, w tym w samodzielnym spożywaniu pokarmów oraz w komunikowaniu swoich potrzeb opiekunom. Część z nich doświadcza też depresji poudarowej, która może istotnie wpływać na obniżenie apetytu chorego.

Produkty zalecane i przeciwwskazane w diecie po udarze mózgu
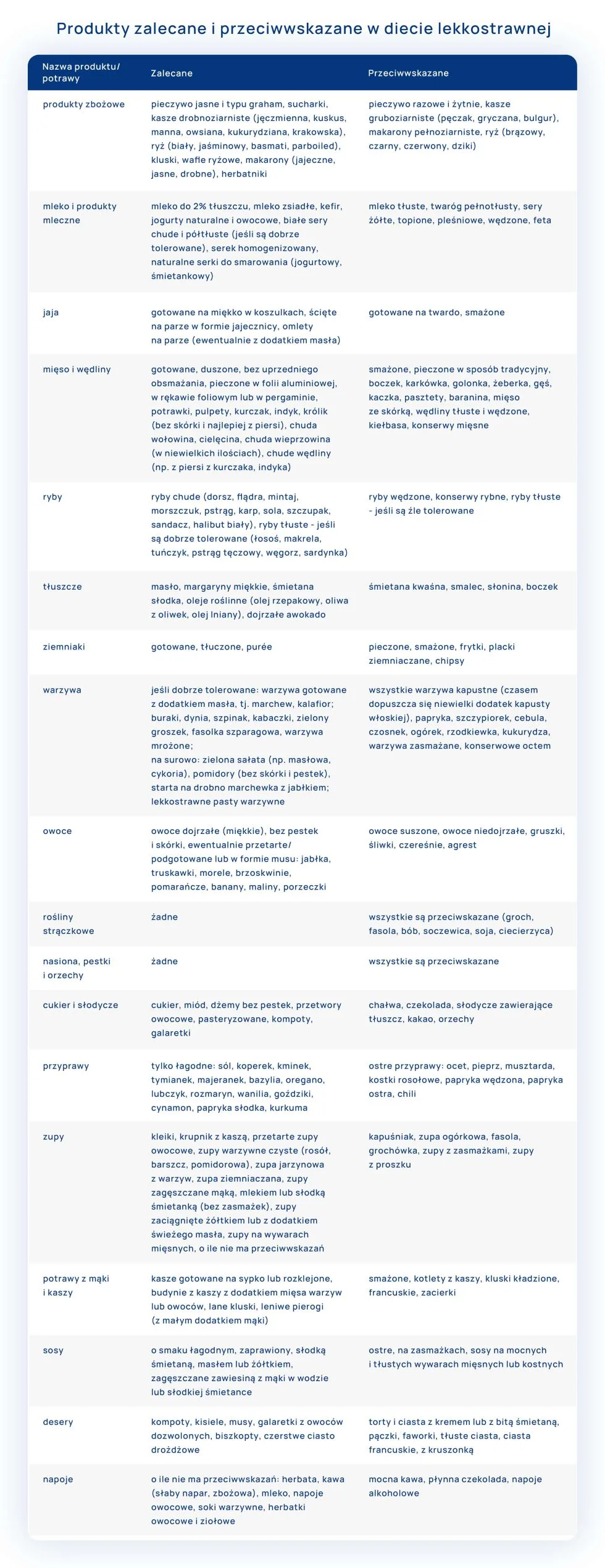
W większości przypadków u pacjentów poudarowych obserwuje się podwyższone ciśnienie krwi i zwiększony poziom cholesterolu. Są to czynniki predysponujące do kolejnego udaru. Z diety po udarze mózgu należy wyeliminować:
- tłuszcze zwierzęce i produkty bogate w cholesterol;
- żywność bogatą w sód – ograniczamy spożycie soli – słone przekąski, konserwy, żywność wysoko przetworzoną oraz typu fast food, ograniczenie soli kuchennej, gotowych mieszanek przyprawowych i kostek bulionowych, gdyż zawierają sporo sodu. Pierwiastek ten występuje w dużej ilości w płatkach zbożowych, pieczywie, serach i przetworach mięsnych (także chudych), dlatego nawet nie dosalając potraw i unikając niezdrowych przekąsek, spożywamy go dużo. Dobrze zatem czytać etykiety i wybierać produkty niskosodowe, czyli zawierające mniej niż 150 mg sodu w porcji;
- słodycze;
- palenie papierosów;
- stres;
- przeciwwskazane są potrawy ciężkostrawne, smażone.
W diecie po udarze mózgu powinny znaleźć się produkty takie jak:
- chude mięso – drób (kurczak, indyk), cielęcina;
- ryby – zawierają zdrowe kwasy omega-3, korzystnie wpływające na układ sercowo-naczyniowy, 2-3 razy w tygodniu jeść ryby morskie;
- mleko i jego przetwory z obniżona zawartością tłuszczu;
- kasze, ryże basmati, jaśminowy brązowy, makarony zalecane pełnoziarniste;
- oliwa z oliwek, oleje roślinne,;
- warzywa i owoce spożywamy w dużych ilościach (75 dag/doba) – 4 porcje warzyw i jedna owoców;
- nasiona roślin strączkowych.
Potrawy należy gotować, piec do miękkości lub dusić. Przyprawiać do smaku ziołami, olejem rzepakowym lub oliwą z oliwek oraz dodawać pestki (dyni słonecznika) oraz nasiona.
Pacjenci zagrożeni niedowagą mogą włączyć do jadłospisu wysokoenergetyczna produkty do żywienia medycznego, zawierające cały zestaw niezbędnych makro- i mikroskładników. Mogą one stanowić oddzielne posiłki lub jako dodatek do tradycyjnych dań, czyniąc je bardziej odżywczymi i zbilansowanymi.
Osoby po udarze mózgu wykazują zwiększone zapotrzebowanie na białko i energię. Zapotrzebowanie energetyczne w fazie ostrej udaru wzrasta do 30-35 kcal/kg należnej masy ciała na dobę, a białka 1,1 do 2g/kg masy ciała na dobę. Kiedy dieta tradycyjna z różnych przyczyn jest niewystarczająca i chory traci masę ciała, wówczas należy sięgnąć po wsparcie żywieniowe w formie specjalistycznych preparatów odżywczych i stosować je jako uzupełnienie diety. Oczywiście przy ciężkiej dysfagii wprowadzane jest żywienie dojelitowe, a wybór diety zależy od potrzeb chorego.
Ważne – sposób żywienia oraz zapotrzebowanie na składniki odżywcze i energetyczne w diecie po udarze mózgu zależą od występowania powikłań u chorego. Należą do nich – zaburzenia połykania, występowanie ryzyka niedożywienia, odleżyn, stopnia samodzielności, prowadzonej rehabilitacji, a także obecności chorób współistniejących. W odżywianiu pacjentów, poza dostarczeniem odpowiedniej ilości składników odżywczych i energii, należy zwrócić szczególną uwagę na kwestie bezpieczeństwa.
W przypadku osób chorych neurologicznie zmagających się z problemem dysfagii, istotny jest dobór odpowiedniej konsystencji produktów stałych i płynów, wyłączenie produktów ryzykownych (np. sypkich, suchych, o ostrych krawędziach) oraz wykonywanie ćwiczeń ułatwiających i poprawiających bezpieczeństwo połykania. Ryzyko zachłyśnięcia można zminimalizować poprzez stosowanie specjalistycznych preparatów służących do zagęszczania płynów i potraw, pozwalających uzyskać konsystencję nektaru, płynnego miodu i puddingu. Takie działania mają szczególne znaczenie dla chorego, ponieważ wypijanie zalecanej ilości płynów ok. 1,5 – 2 l płynów (przy braku innych przeciwwskazań), pozwala utrzymać prawidłowy stan nawodnienia organizmu.
Poza adaptacją diety ważna jest profilaktyka kolejnego udaru, stąd zalecenia żywieniowe powinny dodatkowo koncentrować się na modelu diety śródziemnomorskiej.
Przykłady diety po udarze mózgu
Osoby po udarze mają problemy z jedzeniem, częsty brak apetytu, złe samopoczucie, trudności z poruszaniem i przygotowywaniem posiłków, niemożność posługiwania się sztućcami, a także zaburzenia połykania. W tym przypadku bardzo ważną rolę odgrywa opiekun chorego. Musi on przede wszystkim dbać o bezpieczeństwo chorego w czasie karmienia, pilnować, aby pacjent spożywał wystarczającą ilość energii i składników odżywczych. Zaleca się, aby posiłki były:
- wysokoenergetyczne,
- łatwe w spożyciu (np. o gładkiej konsystencji, w postaci papki),
- smaczne,
- urozmaicone,
- o ładnym zapachu.
Opiekun chorego po udarze mózgu odgrywa niezwykle ważną rolę w procesie opieki nad chorym, ponieważ spędza z nim najwięcej czasu, dzięki czemu może przekazać istotne informacje w procesie leczenia. Czego oczekiwać od opiekuna:
- powinien nadzorować chorego w czasie posiłków,
- sprawdzać poprawność konsystencji podawanych płynów i potraw,
- dbania o prawidłową postawę chorego podczas spożywania posiłków (najlepiej siedzącą),
- nadzorowania poprawności wykonywanych ćwiczeń i manewrów podczas połykania,
- każdy epizod krztuszenia się wymaga przerwania posiłku, sprawdzenia konsystencji, tekstury diety a także konsultacji z lekarzem,
- obserwacji ilości wypijanych napojów, spożywanych potraw oraz apetytu chorego,
- cotygodniowego sprawdzania masy ciała pacjenta – jakakolwiek utrata wagi powinna być skonsultowana z lekarzem i dietetykiem, aby ocenić przyczyny i podjąć odpowiednią interwencję żywieniową celem profilaktyki niedożywienia.
Przykład diety papkowatej (potrawy mielone, przecierane)
I śniadanie
- zupa mleczna z płatkami kukurydzianymi bez cukru
- pasta drobiowa (kurczak gotowany) z pieczarkami i pomidorem, z dodatkiem delikatnych ziół, wszystko razem zblendować
- do picia herbata zielona
II śniadanie
- jogurt z blendowanymi owocami (truskawki, maliny, jabłko) i rozmoczony biszkopt
- mleko oraz bułka wrocławska czy grahamka rozmoczona w tym mleku
- do picia woda
Obiad
- zupa krem z marchewki
- pulpety z indyka z sosem koperkowym, podane z puree ziemniaczanym, buraczki na ciepło starte na drobnej tarce
- kompot z jabłek
lub
- łosoś pieczony w folii – rozdrobnione kawałki podane z ryżem basmati rozgotowanym na papkę, gotowana marchewka rozgnieciona na papkę
Podwieczorek
- jabłko pieczone
lub
- kasza manna z dojrzałym bananem (zblendowane)
Kolacja
- risotto z ryżu i gotowanych warzyw – rozdrobnione
lub
- pasta z makreli i ogórka kiszonego zblendowane na gładką masę, podane z komosą ryżową (rozgotowaną)
- do picia słaba herbata z cytryną (sam sok)
Przeczytaj też: Badania laboratoryjne, które należy wykonać przy diagnostyce nadciśnienia tętniczego
Piśmiennictwo
- H.Ciborowska, A. Rudnicka, „Dietetyka żywienie zdrowego i chorego człowieka”, Wydanie IV rozszerzone i uaktualnione, PZWL
- Peter Kraft „Udar mózgu”, PZWL
- H.Markus, A.Pereira, G.Cloud, Kompendium Diagnostyki i Postępowania „Udary Mózgu” tom I, Wydawnictwo Czelej