Spis treści
- Przyczyny powstawania KUM i rodzaje kamic układu moczowego
- Zalecenia żywieniowe w kamicach nerkowych
Kamica układu moczowego (KUM) jest stanem chorobowym, w którego przebiegu w nerce lub w drogach moczowych tworzą się złogi substancji chemicznych stanowiących prawidłowy, lub patologiczny składnik moczu.
Częstość występowania kamicy układu moczowego (KUM) wynosi 2 do 3%, przy czym ryzyko pojawienia się jej u mężczyzn jest ponad dwukrotnie wyższe niż u kobiet. Szczyt zachorowań u mężczyzn przypada na trzydziesty rok życia, a u kobiet występują 2 szczyty w wieku 35 i 55 lat. Jest to schorzenie charakteryzujące się nawrotami, które pojawiają się u 10% osób, w pierwszym roku od incydentu kolki nerkowej u 35%, w ciągu 5 lat u 50% osób.
W krajach ekonomicznie rozwiniętych obserwuje się systematyczny wzrost liczby zachorowań, co prawdopodobnie związane jest ze zwiększonym spożyciem białka zwierzęcego i niewystarczającą ilością przyjmowanych płynów. Dodatkowo wiele jednostek chorobowych leków i nieprawidłowości anatomicznych sprzyja tworzeniu się złogów w układzie moczowym.
Kamica układu moczowego (KUM) charakteryzuje się dużą różnorodnością wielkości, kształtu, budowy i składu kamieni moczowych. Ich twardość, zabarwienie i skład chemiczny zależą głównie od budowy krystalicznej. Etiologia kamicy układu moczowego (KUM) jest bardzo zróżnicowana, a liczne jej problemy pozostają wciąż niewyjaśnione. Ponadto ten sam rodzaj kamieni może powstawać z różnych powodów. U wielu chorych kamica jest jednym z objawów ogólnoustrojowych zaburzeń przemiany materii lub też następstwem zmian w samym układzie moczowym.
Przyczyny powstawania KUM i rodzaje kamic układu moczowego
Przyczyny powstawania kamicy moczowej:
- duże stężenie w moczu – wapnia, fosforanów, szczawianów, cystyny, kwasu moczowego,
- duże lub zbyt małe stężenie jonów wodorowych (pH) w moczu, zmniejszające rozpuszczalność niektórych składników w moczu,
- niedobór związków ograniczających krystalizację składników moczu, magnezu czy cytrynianów,
- zbyt mała ilość płynów w diecie lub nadmierna ich utrata,
- przewlekłe zakażenie układu moczowego,
- uwarunkowania genetyczne,
- ogólnoustrojowe choroby genetyczne.
Objawy kamicy – w kamicy nerkowej pojawiają się takie objawy jak:
- silny ból w okolicy lędźwiowej,
- kolka nerkowa, wodonercze,
- odmiedniczkowe zapalenie nerek,
- czasem krew w moczu.
Kamienie mogą składać się z:
- szczawianu wapnia,
- fosforanu wapnia,
- fosforanu magnezowo-amonowego,
- moczanów,
- ksantyny – zasady purynowej – prekursora syntezy kwasu moczowego,
- cystyny.
Rodzaje kamicy układu moczowego (KUM) zależą od rodzaju złogów, wyróżnia się:
- kamicę szczawianowo-wapniową,
- kamicę fosforanowo-wapniową,
- kamicę moczanową,
- kamicę fosforanowo-magnezowo-amonową,
- kamicę cystynową,
- kamicę ksantynową.
Zalecenia żywieniowe w kamicach nerkowych
Dieta powinna być uzależniona od rodzaju kamicy. W zapobieganiu kamicy, jak i leczeniu znaczącą rolę odgrywają płyny podawane w odpowiedniej ilości, ponad 2 l/dobę. Ważne jest odpowiednie pH moczu, ograniczenie soli kuchennej, a także produktów bogatych w kwas szczawianowy.
W niektórych przypadkach należy zwrócić uwagę na podaż wapnia, fosforu, magnezu i białka. Dieta bogata w białko zwierzęce może sprzyjać powstawaniu kamicy.
W kamicy nerkowej chorym zalecane są następujące płyny – woda przegotowana, wody niegazowane, wody mineralne, napar z brzozy czy słabe herbaty. Ważne są płyny podawane przed snem, rozcieńczają one mocz w godzinach nocnych.
Sód nie sprzyja kamicy szczawianowo-wapniowej, zwiększa on wydalanie wapnia i moczanu sodu. Z diety należy wyeliminować lub maksymalnie ograniczyć wszystkie przetwory z dodatkiem soli, koncentraty spożywcze oraz przyprawy zawierające glutaminian sodu.
Zmniejszona podaż wapnia w żywieniu prowadzi do upośledzenia mineralizacji kości, a także wzmaga wchłanianie szczawianów i wydalanie ich z moczem.
Podaż wapnia ogranicza się tylko w przypadku zwiększonego wchłaniania jelitowego tego pierwiastka.
Podaż fosforu ogranicza się w diecie u chorych cierpiących na kamicę fosforanowo-magnezowo-amonową.
Kamica szczawianowo-wapniowa
Kamica szczawianowo-wapniowa występuje:
- w przypadku nadmiernej ilość kwasu szczawiowego,
- szczawianów w moczu,
- w chorobach zapalnych jelit,
- po resekcji jelit
- przy bardzo dużej podaży witaminy C,
- w niedoborze witaminy B6,
- przy zaburzonym wydalaniu jonów wodorowych przez nerki.
W zwiększonym jelitowym wchłanianiu wapnia i szczawianów należy ograniczyć z diet produkty będące źródłem tych składników.
W kamicy szczawianowo-wapniowej występuje nadmiar sodu w diecie, zwiększa on wydalanie z organizmu moczanu sodu i wapnia. Moczany sodu mogą być jądrem krystalizacji złogów szczawianu wapnia. W tym przypadku ograniczamy w diecie produkty z dodatkiem soli.
Jeżeli kamica została spowodowana nadmiernym wydalaniem wapnia przez nerki (w nadczynności tarczycy czy osteoporozie), wtedy podaży wapnia z diety się nie ogranicza. Zaleca się natomiast zwiększyć ilość inhibitorów krystalizacji złogów magnezu, cytrynianów, fosforanów, a także płynów co najmniej do ilości 2 l/dobę. Ważne, aby ograniczyć białko zwierzęce.
Produkty przeciwwskazane w kamicy szczawianowo-wapniowej:
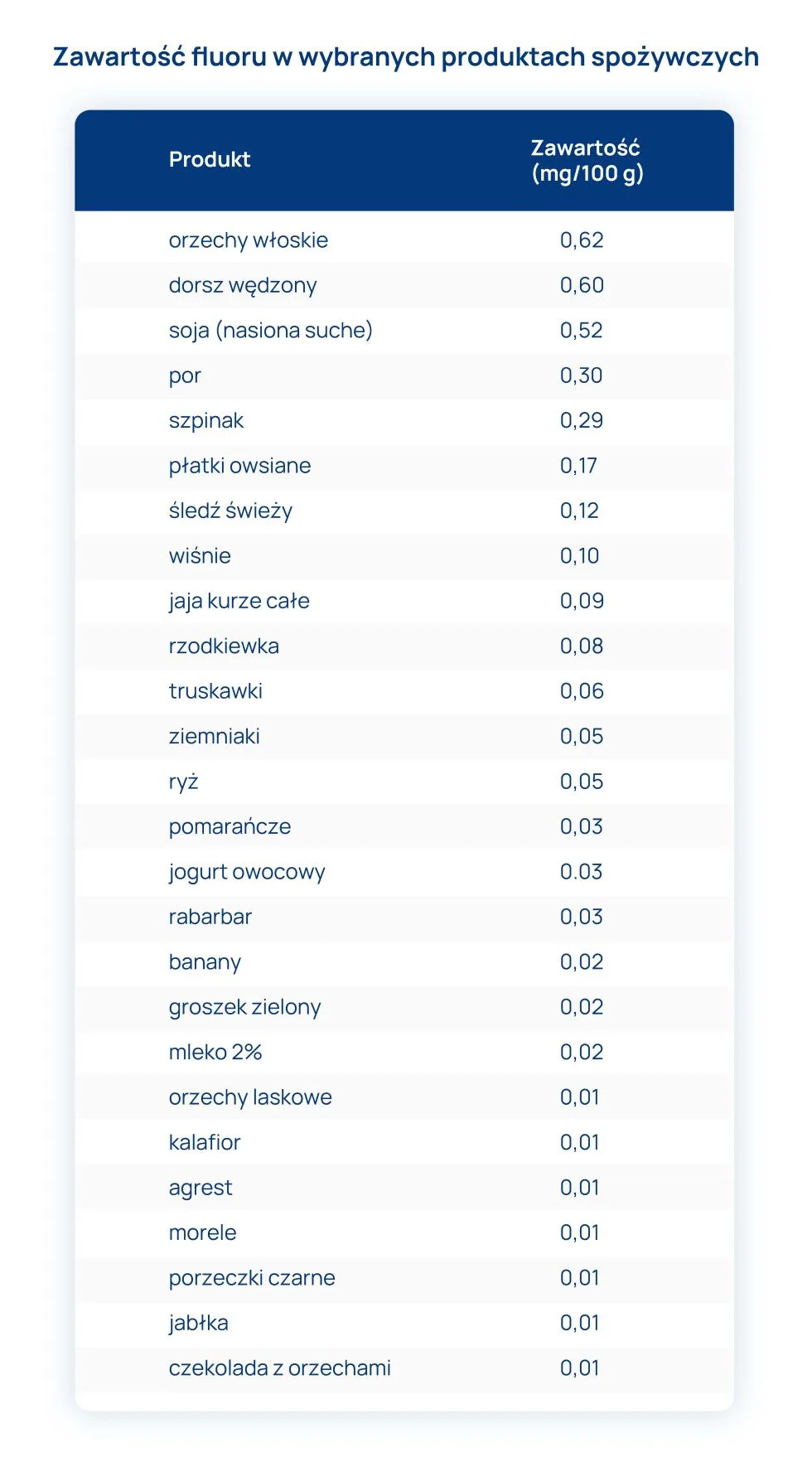
szpinak, szczaw, rabarbar, boćwina, suszone figi, kiszonki, konserwy wszystkie (np. rybne, mięsne), czekolada, kakao, mocna herbata, kawa, koncentraty sup, sosów, ostre przyprawy, produkty zawierające glutaminian sodu.
Produkty dozwolone w ograniczonych ilościach w kamicy szczawianowo-wapniowej:
mleko i przetwory mleczne, mięso i przetwory mięsne, ryby, jaja, ziemniaki, marchew, buraki, groch, pomidory, nasiona roślin strączkowych, zielone warzywa liściaste, kapusta, sałata, śliwki, agrest, cukier, orzechy.
Produkty zalecane w kamicy szczawianowo-wapniowej:
duża ilość wody, słabe herbaty, soki owocowe, owoce cytrusowe, produkty zbożowe z pełnego ziarna, ogórki, cebula, kukurydza, masło.

Przykładowa dieta w kamicy szczawianowo-wapniowej
I śniadanie
Pieczywo posmarowane masłem z jajecznicą na parze do tego ogórek zielony. Do picia słaba herbata bez cukru.
II śniadanie
Płatki owsiane (zalane wrzątkiem, odlewamy wrzątek po kilku minutach, aby wypłukać z płatków szczawiany), dodajemy jogurt naturalny 2% oraz mandarynki/nektarynki czy morele. Do picia woda niegazowana.
Obiad
Zupa buraczkowa z dodatkiem marchewki, ziemniaków oraz kaszy jaglanej.
Udziec z indyka (upieczony w piekarniku) obtoczony delikatnymi ziołami z makaronem ryżowym oraz surówka z kapusty pekińskiej i marchewki. Do picia wyciskany sok owocowy z pomarańczy.
Podwieczorek
Garstka orzechów włoskich. Do picia woda mineralna.
Kolacja
Łosoś pieczony w piekarniku, podany z pieczywem pełnoziarnistym posmarowanym masłem. Surówka z sałaty, pomidora i zielonego ogórka, doprawiona ziołami, skropiona kilkoma kroplami cytryny i oleju rzepakowego. Do picia słaba herbata bez cukru.
Kamica fosforanowo-wapniowa
- głównym składnikiem złogów jest fosforan wapnia
- powstaje w moczu zasadowym
- odczyn zasadowy moczu wynika z zakażenia niektórymi bakteriami, rozkładającymi mocznik na amoniak i dwutlenek węgla
- zwiększenie stężenia amoniaku prowadzi do alkalizacji moczu
W diecie chorego należy ograniczyć sól oraz produkty bogate w fosforany, wapń i szczawiany – mleko, jaja, przetwory mleczne, sery podpuszczkowe, rośliny strączkowe czy konserwy rybne.
Należy zwiększyć ilość magnezu, cytrynianów i wypijanych płynów. Dieta powinna zawierać pokarmy zakwaszające – mięso, wędliny, ryby, pieczywo.
Produkty przeciwwskazane w kamicy fosforanowo-wapniowej:
przetwory solone, produkty zawierające glutaminian sodu, mocna herbata, kawa, czekolada, kakao, szpinak, szczaw, rabarbar, nasiona roślin strączkowych, wody alkaliczne mineralne.
Produkty dozwolone w ograniczonych ilościach w kamicy fosforanowo-wapniowej:
mleko, jaja, owoce, ziemniaki, warzywa.
Produkty zalecane w kamicy fosforanowo-wapniowej:
duże ilości płynów, soki i owoce cytrusowe, mięso, ryby, pieczywo, gruboziarniste kasze, makarony, masło, miód.
Przykładowa dieta w kamicy fosforanowo-wapniowej
I śniadanie
Pieczywo żytnie pełnoziarniste posmarowane masłem, szynka z piersi indyka i czerwona papryka. Sok wyciskany grejfrutowo-pomarańczowy. Woda niegazowana.
II śniadanie
Bułka grahamka z masłem i miodem. Kawa zbożowa z mlekiem.
Obiad
Zupa warzywna na piersi z indyka/kurczaka bez skóry, z kaszą jaglaną i ziemniakami, zabielona mlekiem 1,5%.
Łosoś pieczony w piekarniku, obtoczony delikatnymi ziołami, podany z kaszą bulgur. Do tego buraczki na ciepło. Woda mineralna.
Podwieczorek
Warzywa pieczone w piekarniku (marchew, pietruszka, seler) do tego mięso z piersi kurczaka ugrillowane w ziołach. Do picia słaba herbata.
Kolacja
Pieczywo pełnoziarniste do tego jajka na twardo pokrojone w plasterki. Pomidor pokrojony w plastry. Do picia słaba herbata owocowa.
Kamica moczanowa
- najczęstszą przyczyną powstawania kamicy moczanowej jest dieta bogatopurynowa
- złogi w kamicy moczanowej tworzą się kwasu moczowego (jest to końcowy produkt przemiany materii), normalnie znajduje się on w stanie rozpuszczonym
- kwas moczowy powinien być wydalany przez nerki, kamienie moczanowe wytrącają się w moczu kwaśnym i nadmiernie zagęszczonym wtedy, gdy pH wynosi mniej niż 5,3,kamicy sprzyja zwiększone stężenie kwasu moczowego w moczu
W diecie należy ograniczyć podaż związków purynowych, występujących przede wszystkim w wyrobach mięsnych, grzybowych, a także podaż białka, wpływa na zmniejszenie zawartości kwasu moczowego w moczu. Zalecane jest spożycie białka 40-50g na dobę. W diecie zwiększamy płyny do ponad 2l na dobę. Dieta powinna alkalizować mocz, ponieważ kwas moczowy rozpuszcza się w środowisku alkalicznym. Pacjentom zalecana jest dieta mleczno-jarska – mleko, warzywa i owoce mają właściwości alkalizujące. Stężenie jonów wodorowych nie powinno obniżyć się poniżej 6,5-7,0 pH, przy niższym pH może dojść do wytrącania się kryształków fosforanu wapnia.
Produkty przeciwwskazane w kamicy moczanowej:
wywary mięsne, rybne, podroby, baranina, wieprzowina, śledzie, sardynki, szproty, rośliny strączkowe, grzyby, orzechy, mocna herbata, czekolada, kakao, naturalna kawa.
Produkty dozwolone w ograniczonych ilościach w kamicy moczanowej:
produkty zbożowe, ryby, drób, pozostałe gatunki mięs w ilości 100-150 g/dobę, tylko gotowane w dużej ilości wody, ponieważ puryny przechodzą do wywaru.
Produkty zalecane w kamicy moczanowej:
wypijanie dużej ilości płynów ponad 2 l/dobę, wody mineralne, warzywa i owoce – polecane są cytryny zwiększają przemianę puryn, mleko, ser twarogowy chudy, ziemniaki, miód, cukier.
Przykładowa dieta w kamicy moczanowej
I śniadanie
Pieczywo niskobiałkowe posmarowane masłem, twarożek z serka chudego i jogurtu naturalnego ze szczypiorkiem. Do tego pomidor i papryka. Do picia sok warzywno-owocowy.
II śniadanie
Brokuł na parze do tego bułki niskobiałkowe, gotowana pierś z kurczaka bez skóry. Do picia kawa zbożowa z mlekiem 1,5%.
Obiad
Zupa pomidorowa na samych warzywach z ryżem jaśminowym.
Pierogi z serem na słodko. Surówka z pora, jabłka i marchewki z dodatkiem jogurtu naturalnego 2%. Do picia delikatna herbata.
Podwieczorek
Koktajl warzywny z dodatkiem ulubionych ziół. Do picia woda niegazowana.
Kolacja
Pieczywo niskobiałkowe z miodem. Papryka, marchew i rzodkiewki do pochrupania. Do picia herbata słaba z cytryną i cukrem (odrobiną).
Kamica fosforanowo-magnezowo-amonowa
Wytrąca się w moczu alkalicznym, gdy układ moczowy zakazi się bakteriami wytwarzającymi enzym ureazę.
Z diety należy wyeliminować produkty, których są źródłem – mleko, sery dojrzewające, sery topione, żółtko jaja, mięso i jego przetwory, podroby, ryby, konserwy, produkty zbożowe gruboziarniste, suche nasiona roślin strączkowych, czekolada oraz orzechy. Koniecznie należy spożywać duże ilości płynów ponad 2 l/dobę. Należy obserwować mocz, jeżeli w moczu występuje małe stężenie cytrynianów i magnezu, należy do diety wprowadzić większe ilości soków i owoców cytrusowych, a także bogate w magnez warzywa.
Kamica cystynowa
Z diety należy ograniczyć aminokwas siarkowy (cystyny). Występuje on obficie w produktach nabiałowych. Płyny należy zwiększyć do dwukrotnej objętości normalnego zapotrzebowania – ponad 3 l na dobę. Należy zwiększyć podaż lub suplementację witaminy B6.
Kamica ksantynowa
Spowodowana jest nadmiarem w moczu zasady purynowej – ksantyny. Ksantyna jest pochodną guaniny, występuje w tkankach roślinnych i zwierzęcych, jest bezpośrednim prekursorem syntezy kwasu moczowego.
W diecie należy uwzględnić produkty, które alkalizują mocz. Dieta mleczno-jarska prowadzi do alkalizacji moczu. Należy zwiększyć ilość podawanych płynów w diecie.
>>> Przeczytaj też: Dieta w przewlekłej chorobie nerek
Piśmiennictwo
- H.Ciborowska, A.Rudnicka „Dietetyka żywienie zdrowego i chorego człowieka”, PZWL, Warszawa 2014r.
- D.Włodarek, E.Lange, L.Kozłowska, D.Głąbska, „Dietoterapia”, PZWL, Warszawa 2015r. Lucyna Kozłowska „Kamice układu moczowego”