Spis treści
- Czym jest błonnik?
- Korzyści z błonnika. Jak działa błonnik na organizm człowieka?
- Zapotrzebowanie na błonnik pokarmowy. Źródła błonnika w diecie. Jak włączyć błonnik do codziennej diety? Wskazówki praktyczne
- Czy można przedawkować błonnik?
Czym jest błonnik?
Błonnik pokarmowy nazywany jest inaczej włóknem pokarmowym i stanowi pozostałość komórek roślinnych, które – dzięki temu, iż są oporne na działanie enzymów trawiennych – przechodzą w postaci niestrawionej przez jelito cienkie, aby ulec degradacji bakteryjnej (błonnik rozpuszczalny) w jelicie grubym, gdzie stanowią pożywkę dla mikrobioty jelitowej.
Chemicznie błonnik pokarmowy to frakcja wielocukrów (celuloza, hemiceluloza,pektyny) oraz składników nie-węglowodanowych (ligniny). Inne substancje wchodzące w skład błonnika to agar, woski, gumy i śluzy roślinne oraz beta-glukany. Dodatkowo inne związki, takie jak saponiny, fityniany, kutyna.
Błonnik to struktura niejednorodna, jednym z ważnych kryteriów jego podziału jest wyróżnienie błonnika nierozpuszczalnego i rozpuszczalnego.
Błonnik nierozpuszczalny to celuloza i ligniny. Błonnik rozpuszczalny to pektyny, beta-glukany, gumy, śluzy roślinne, niektóre hemicelulozy, a także skrobia oporna.
Ten ostatni składnik błonnika nie występuje w roślinach w naturze. Jest efektem ogrzewania skrobi w niedostatecznej ilości wody, w wynik czego powstaje skrobia oporna na działanie enzymów trawiennych. Ma to miejsce np. w czasie produkcji płatków śniadaniowych.

Korzyści z błonnika. Jak działa błonnik na organizm człowieka?
Definicja błonnika pokarmowego podkreśla, iż powinna go cechować przynajmniej jedna z poniższych właściwości:
- zmniejszanie czasu pasażu jelitowego i zwiększanie objętości stolca,
- stymulowanie procesów fermentacji jelitowej,
- obniżanie poposiłkowego stężenia glukozy i poziomu insuliny,
- obniżanie stężenia cholesterolu całkowitego i frakcji LDL.
Błonnik nierozpuszczalny w wodzie odpowiedzialny jest za następujące działania:
- pobudzanie wydzielania śliny i hormonów przewodu pokarmowego (gastryny), zwiększenie wydzielania soków trawiennych, buforowanie i wiązanie nadmiaru kwasu solnego w żołądku,
- wiązanie wody i zwiększanie objętości treści pokarmowej, pobudzanie perystaltyki jelit poprzez mechaniczne drażnienie ścian jelita, pobudzenia ukrwienia jelit,
- zmniejszanie wartości energetycznej diety i zwiększanie poczucia sytości,
- skracanie czasu pasażu przez przewód pokarmowy, a co za tym idzie przeciwdziałanie zaparciom, żylakom odbytu, nowotworom.
Błonnik rozpuszczalny w wodzie wywiera korzystne działanie poprzez:
- obniżanie poziomu cholesterolu we krwi,
- obniżanie glikemii poposiłkowej i stężenia insuliny,
- wychwytywanie substancji toksycznych (bakteryjnych, jonów metali ciężkich),
- rozluźnianie mas kałowych – pomocne w zaparciach,
- zwiększanie gęstości treści pokarmowej – dzięki temu jest efektywny u osób z biegunkami,
- stanowienie pożywki dla mikrobioty jelitowej (błonnik rozpuszczalny ulega biodegradacji w jelicie grubym).
Ta ostatnia funkcja jest istotna ze względu na zapewnienie bakteriom jelitowym optymalnych warunków do rozwoju. Produktami bakteryjnej degradacji błonnika są wodór, metan i kwasy tłuszczowe, m.in. kwas masłowy, dostarczający energii komórkom błony śluzowej jelit.

Zapotrzebowanie na błonnik pokarmowy. Źródła błonnika w diecie. Jak włączyć błonnik do codziennej diety? Wskazówki praktyczne
Zapotrzebowanie na błonnik pokarmowy nie zostało określone, natomiast precyzuje się dawki wystarczające lub zalecane. Rekomendacje bazują m.in. na obserwacjach jakie dawki błonnika zapewniają prawidłowe funkcjonowanie przewodu pokarmowego, obniżenie poziomu cholesterolu i utrzymanie optymalnej glikemii po posiłku.
EFSA – Europejski Urząd ds. Bezpieczeństwa Żywności określa, iż dawka błonnika w wysokości 25 g/dziennie dla osób dorosłych jest tzw. dawką wystarczającą (AI – Adequate Intake). Osoby starsze mogą zmniejszyć tę dawkę do 20 g/dziennie, u dzieci wynosi 10-21 g/dziennie.
WHO zaleca spożycie 25 g błonnika dziennie. Zalecenia francuskie to 30 g/dziennie, natomiast w Wielkiej Brytanii 18 g/dziennie.
EFSA wskazuje, iż u ludzi dorosłych spożycie błonnika wyższe niż 25 g/dobę pomaga w utrzymaniu należytej masy ciała i zmniejsza ryzyko wystąpienia chorób dietozależnych.
Z kolei ILSI (International Life Science Institute) publikuje dane, zgodnie z którymi wskazane jest, aby na każde 1000 kcal spożywanego posiłku przypadało 10 g włókna pokarmowego.
Rekomendacje dotyczące przyjmowania określonych dawek błonnika nie precyzują zaleceń dla poszczególnych rodzajów włókien, dotyczą one zbiorczo zarówno frakcji rozpuszczalnej, jak i nierozpuszczalnej. Jedynie U.S. Department of Health and Human Services wspomina, iż w celu obniżenia wysokiego poziomu LDL-cholesterolu powinniśmy zjadać 10-25 g błonnika rozpuszczalnego dziennie, a w celach profilaktyki zdrowotnej co najmniej 5-10 g.
Niższe spożycie błonnika może być zalecane u osób z niedożywieniem i rekonwalescentów, gdzie ważne może być maksymalne wykorzystanie energii i składników odżywczych z diety.
Główne źródło błonnika w diecie w Polsce to produkty zbożowe – ok. 54% spożywanego włókna. Warzywa, owoce, ziemniaki to 33%.
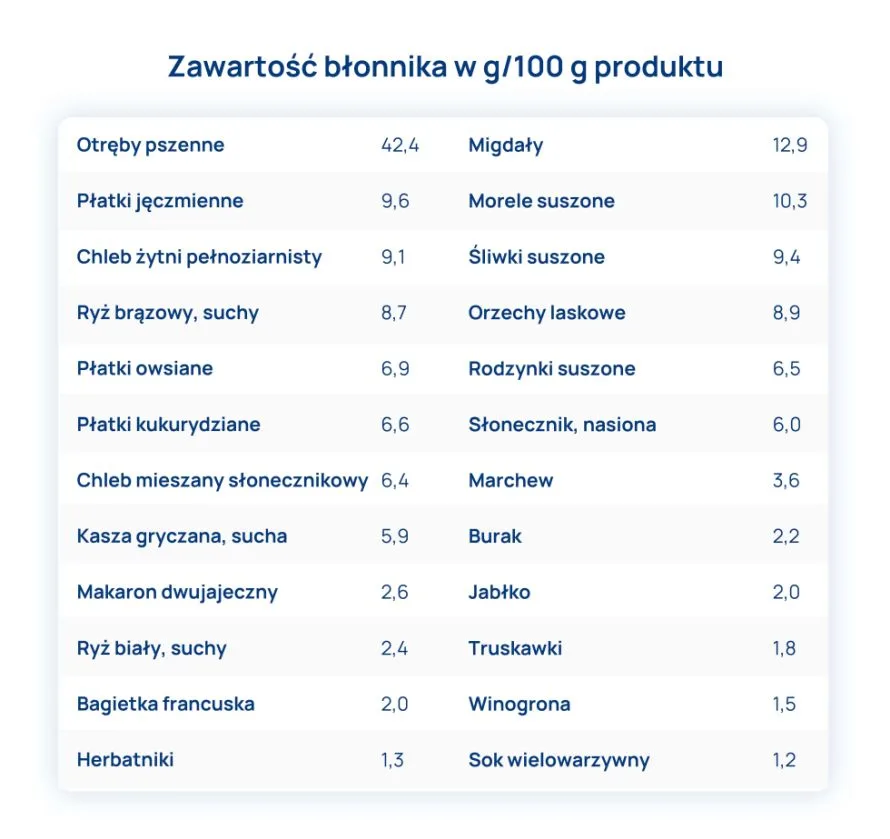
We wszystkich produktach żywnościowych występuje zarówno błonnik rozpuszczalny, jak i nierozpuszczalny, chociaż w zróżnicowanych proporcjach.
Bogatym źródłem błonnika rozpuszczalnego są zboża (owies, jęczmień), owoce (jabłka, cytrusy), warzywa (korzeniowe – pietruszka, marchewka), strączki. W praktyce dobrym źródłem błonnika rozpuszczalnego jest babka płesznik. Jeśli nie musimy zażywać wyższych dawek błonnika, wystarczy 1-2 łyżeczki dodać do szklanki wody i po pewnym czasie wypić. Jeśli musimy zażywać więcej błonnika rozpuszczalnego, należy dodać odpowiednio więcej nasion babki płesznik, pamiętając, iż 1 łyżeczka od herbaty to 5 g produktu.

Takie spożywanie błonnika jest optymalne, ponieważ do jego prawidłowego działania w przewodzie pokarmowym wymagana jest odpowiednia dawka płynów, co nie zawsze ma miejsce w przypadku, gdy zażywamy tabletki z włóknem pokarmowym.

Czy można przedawkować błonnik?
Dieta zachodnia nie dostarcza optymalnej ilości błonnika pokarmowego, obserwuje się raczej jego niedobór niż nadmiar. Jednak wspomnieć należy, iż – w trosce o swoje zdrowie – nie należy spożywać nadmiernych ilości błonnika, ponieważ może to mieć niekorzystny wpływ na przyswajanie składników pokarmowych z diety. Przyspieszenie pasażu przez przewód pokarmowy, biegunka i zawarty w błonniku kwas fitynowy to mechanizmy, które mogą skutkować niekorzystnym działaniem.
Na dzisiaj nie zostały określone maksymalne dawki błonnika, które można spożywać, dlatego osoby suplementujące błonnik powinny obserwować swój organizm i reagować na skutki ewentualnego nadmiernego spożycia.
Piśmiennictwo
- Ciborowska H., Rudnicka A., Dietetyka. Żywienie zdrowego i chorego człowieka. Wydawnictwo Lekarskie PZWL, Warszawa 2015.
- Normy żywienia dla populacji Polski i ich zastosowanie – pod red. M. Jarosza, E. Rychlik, K. Stoś, J. Charzewskiej Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, 2020.