Spis treści
- Adiponektyna – rola w organizmie ludzkim
- Adiponektyna w procesach nowotworzenia
- Badanie stężenia adiponektyny
- Podsumowanie
Adiponektyna to białko wydzielane przez adipocyty, czyli główny rodzaj komórek, budujących tkankę tłuszczową. Naukowcy odkryli, że pełni ono ważną rolę w przekazywaniu informacji pomiędzy tkanką tłuszczową a organami, które kontrolują trawienie i inne procesy metaboliczne w organizmie. Od tego czasu powstało wiele publikacji naukowych, które wyjaśniły fizjologiczne funkcje adiponektyny w otyłości, cukrzycy, miażdżycy i chorobach sercowo-naczyniowych.
Adiponektyna – rola w organizmie ludzkim
Adiponektyna wpływa na wątrobę, serce, trzustkę, nerki, mięśnie, jądra, jajniki i wiele typów komórek w różnych tkankach. Główne funkcje tego białka w organizmie ludzkim obejmują:
- korzystne działanie metaboliczne i poprawę homeostazy energetycznej całego organizmu poprzez hamowanie produkcji glukozy, zmniejszenie gromadzenia się lipidów w wątrobie, zwiększenie utleniania kwasów tłuszczowych w mięśniach szkieletowych oraz wrażliwości na insulinę;
- ochronę przed szeregiem zdarzeń patologicznych w komórkach wskutek hamowania apoptozy (śmierci komórkowej), stanu zapalnego oraz zwiększania przeżywalności komórek;
- ochronę układu sercowo-naczyniowego przez działanie przeciwzapalne i antyoksydacyjne oraz zmniejszanie ryzyka rozwoju miażdżycy;
- zapobieganie rozwojowi nowotworów;
- udział w regulacji apetytu i utrzymaniu prawidłowej masy ciała.
Wyjaśnienie podstawowych mechanizmów podczas badań nad adiponektyną pomogło także ustalić, że tkanka tłuszczowa pełni istotną rolę jako ważny narząd endokrynny.
Poziom adiponektyny jest często obniżony u osób otyłych, z cukrzycą typu 2 i chorobami sercowo-naczyniowymi, co sugeruje związek między niedoborem tego białka a występowaniem tych schorzeń. Jest to tzw. paradoks adiponektyny – pomimo wytwarzania tego białka przez komórki tłuszczowe jego stężenie jest niższe u osób z nadwagą, a wyższe u osób z prawidłową masą ciała. Utrata wagi, w tym zmniejszenie tkanki tłuszczowej, towarzyszy wzrostowi poziomu adiponektyny i zwiększonej wrażliwości na insulinę. Z tego względu adiponektyna stanowi potencjalny biomarker w oznaczaniu insulinooporności.
Poznanie budowy zarówno adiponektyny, jak i jej receptorów dostarczyło wskazówek istotnych do lepszego zrozumienia mechanizmów molekularnych i pozwoliło na tworzenie mimetyków adiponektyny (substancje chemiczne lub biologiczne, które imitują lub naśladują działanie naturalnych białek w organizmie) z potencjalnie korzystnymi efektami w leczeniu cukrzycy, miażdżycy i chorób sercowo-naczyniowych.

Adiponektyna w procesach nowotworzenia
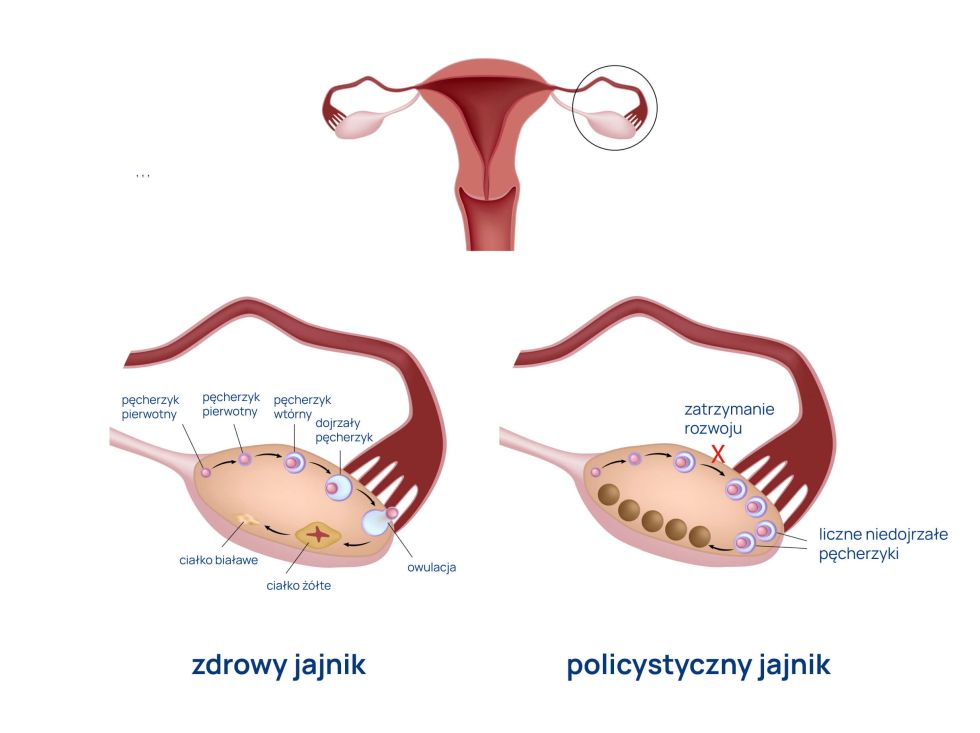
Badania dotyczące roli adiponektyny w procesie nowotworzenia w ostatnich latach nabierają tempa. Naukowcy odkryli, że otyłość i tkanka tłuszczowa są ściśle związane z rozwojem kilku nowotworów, takich jak nowotwór wątroby, trzustki, prostaty i jelita grubego. U ludzi otyłych dochodzi do zaburzenia produkcji adipokin, co prowadzi do zwiększenia wytwarzania onkogennych białek, takich jak leptyna, i spadku stężenia adiponektyny, która odgrywa rolę ochronną. Istnieją dowody na przeciwproliferacyjne działanie adiponektyny w procesach nowotworzenia, szczególnie w przypadku nowotworów kobiet, np. nowotworów szyjki macicy, jajnika, błony śluzowej macicy i piersi. Adiponektyna zmniejsza „szkodliwość” (zdolność migracji i inwazji) komórek rakowych, hamuje ich wzrost i namnażanie się (proliferację) oraz pomaga w wywoływaniu ich apoptozy, czyli śmierci.
Badanie stężenia adiponektyny
W celu wspomagania diagnostyki chorób związanych z nadmiarem lub niedoborem adiponektyny przeprowadza się jej ilościowe oznaczenie w ludzkiej surowicy lub osoczu, stosując test immunoenzymatyczny ELISA (ang. enzyme-linked immunosorbent assay). Adiponektyna nie podlega wahaniom dobowym w surowicy krwi, dlatego badanie można wykonać o każdej porze dnia, a materiałem do badania jest krew.

Stężenie adiponektyny we krwi jest odwrotnie proporcjonalne do wskaźnika BMI (masy ciała) oraz stężenia insuliny i triglicerydów. Oznacza to, że im wyższe jest BMI (indeks masy ciała) oraz stężenie insuliny i triglicerydów we krwi pacjenta, tym niższe jest stężenie adiponektyny. Wyższe jej stężenie obserwuje się u kobiet niż u mężczyzn. Ponadto typowe jest zmniejszenie stężenia adiponektyny wraz z wiekiem.
Niskie stężenie adiponektyny i zwiększony poziom leptyny w otyłości powodują przewlekły stan zapalny, który sprzyja rozwojowi insulinooporności, nadciśnieniu tętniczemu, miażdżycy i innym chorobom układu sercowo-naczyniowego.
Podsumowanie
Adiponektyna odgrywa kluczową rolę w regulacji metabolicznej i utrzymaniu homeostazy energetycznej całego organizmu. W ciągu ostatnich dwóch dekad liczne badania wykazały, że białko to wywiera różnorodny wpływ na narządy, np. zaangażowane jest w ochronę nerek u cukrzyków, może również hamować rozwój miażdżycy. Adiponektyna została także znaleziona w mózgu – reguluje pobieranie pokarmu i ma wpływ na apetyt. Z kolei w wątrobie silnie hamuje glukoneogenezę (produkcję glukozy z substratów, takich jak aminokwasy i glicerol), jednocześnie zwiększając wykorzystanie składników odżywczych w mięśniach szkieletowych. Uczestniczy również w zapobieganiu procesom nowotworzenia.
Badania nad adiponektyną pomogły poznać rolę tkanki tłuszczowej w organizmie. Zmniejszone stężenie tego białka we krwi może wskazywać na rozpoczęcie procesów poprzedzających rozwój otyłości, nadciśnienia tętniczego czy insulinooporności.
>>> Przeczytaj też: Leptyna – hormon głodu i sytości
Piśmiennictwo
- Wang V.Z. et al., Adiponectin, The past two decades, Journal of Molecular Cell Biology 2016; 8(2), 93–100
- Fiaschi T., Mechanisms of Adiponectin Action, International Journal of Molecular Sciences 2019; 20, 2894; doi:10.3390/ijms20122894