Białaczka, czyli najczęstszy złośliwy nowotwór u dzieci to choroba o wielu obliczach, wliczając w to objawy, przebieg, rokowanie i sposób leczenia.
Spis treści:
- Skąd się bierze białaczka u dzieci?
- Jakie są objawy białaczki u dziecka?
- Jakie badania należy wykonać, gdy podejrzewa się białaczkę u dziecka?
- Czy białaczce można zapobiec?
- Białaczka u dzieci – podsumowanie
Skąd się bierze białaczka u dzieci?
Białaczka to heterogenna grupa nowotworów układu krwiotwórczego, które powstają w wyniku nieprawidłowego różnicowania się leukocytów – komórek układu odpornościowego. Według danych literaturowych od wielu lat białaczka jest najczęstszym nowotworem złośliwym u dzieci i stanowi około 30% wszystkich diagnozowanych przed 15. rokiem życia. W zależności od dynamiki procesu nieprawidłowego, niekontrolowanego różnicowania się komórek układu krwiotwórczego, a także od rodzaju samych komórek, wyróżnia się 4 główne rodzaje białaczek:
- ostra białaczka limfoblastyczna (ALL): najczęstsza postać w populacji pediatrycznej, szczyt występowania przypada na okres między 2. a 10. rokiem życia, występuje częściej u dzieci z trisomią 21, nerwiakowłókniakowatością typu 1, zespołem Blooma i ataksją-teleangiektazją (w tych przypadkach białaczka pojawia się między 2. a 3. rokiem życia); rozpoznanie choroby u niemowlęcia wiąże się z gorszym rokowaniem;
- ostra białaczka szpikowa (AML): stanowi 15-20% przypadków, pochodzi z komórek, które różnicują się do krwinek białych, czerwonych oraz płytek krwi, stąd duża złośliwość tego nowotworu; szczyt zachorowań przypada między 1. a 2. rokiem życia i na wiek nastoletni;
- przewlekła białaczka limfoblastyczna (CLL): bardzo częsta u dorosłych, u dzieci ekstremalnie rzadka;
- przewlekła białaczka szpikowa (CML): stanowi 2-4% wszystkich białaczek u dzieci, na ogół zaczyna pojawiać się po 8. miesiącu życia, a szczyt zachorowań przypada powyżej 10. roku życia i częściej dotyczy chłopców.
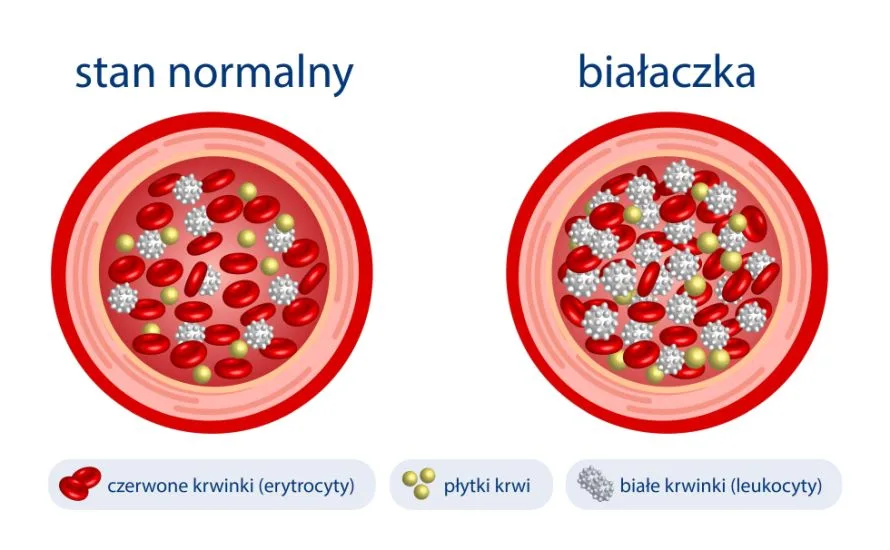
Postęp w zakresie diagnostyki molekularnej, w tym genetycznej sprawia, że podział tej grupy chorób ulega dynamicznym zmianom, coraz częściej bowiem odkrywane są charakterystyczne podtypy poddające się leczeniu celowanemu. Dzięki temu obecnie około 90% pacjentów ma szansę na wyleczenie, co jest ogromnie ważne, tym bardziej że według danych Amerykańskiej Akademii Pediatrii częstość występowania białaczek wzrasta o około 0,7% na rok, licząc od 1975 roku.
Jakie są objawy białaczki u dziecka?
Objawy białaczki zależą od jej rodzaju, jednak w większości przypadków są niecharakterystyczne i łatwo można je pomylić z innymi chorobami tłumaczącymi dolegliwości dziecka:
- ALL: według danych naukowych u ponad połowy dzieci podczas badania stwierdza się co najmniej 1 z 5 wymienionych: powiększenie wątroby i/lub śledziony, bladość, gorączka, obecność siniaków. U większości pacjentów obserwuje się nocne poty, łatwe powstawanie siniaków, bladość skóry, niewyjaśnione powiększenie węzłów chłonnych, osłabienie, utratę masy ciała, trudności w oddychaniu. Mogą również występować bóle kości, zmiany psychiczne i skąpomocz, a także powiększenie jąder, bóle mięśniowo-szkieletowe. W rzadkich przypadkach jednym z pierwszych objawów może być tzw. zespół żyły głównej górnej.
- AML: główne objawy to gorączka, łatwa męczliwość, krwawienia do skóry lub błon śluzowych, bóle kości, bladość oraz niezamierzona utrata masy ciała. U pacjentów z tzw. monocytarnymi podtypami AML sporadycznie obserwuje się przerost dziąseł i naciek skóry, mogą również występować wyraźne guzy lite, zazwyczaj w obrębie czaszki.
- CLL i CML: u wielu pacjentów w momencie rozpoznania nie występują objawy, a choroba jest wykrywana przypadkowo po oznaczeniu morfologii krwi z innego powodu. Gdy jednak choroba daje objawy, są to zazwyczaj: zmęczenie i osłabienie, ból brzucha (głównie z powodu powiększenia wątroby i śledziony), utrata apetytu, spadek masy ciała, nawracające infekcje.
>> Przeczytaj też: Czym są markery nowotworowe i jakich dostarczają informacji?
Jakie badania należy wykonać, gdy podejrzewa się białaczkę u dziecka?
Podstawą wstępnego rozpoznania (bez szczegółowego różnicowania konkretnego podtypu) jest oznaczenie morfologii krwi obwodowej z rozmazem. W większości przypadków badanie pozwala stwierdzić obecność nieprawidłowych krwinek białych, tzw. blastów.

Dalsza diagnostyka odbywa się już w ramach ośrodka referencyjnego. Silne podejrzenie białaczki wymaga natychmiastowej hospitalizacji. Próby „samodzielnego” diagnozowania są zagrożeniem dla życia dziecka.
Należy jednak pamiętać, że w rzeczywistości najpierw pojawiają się objawy, a następnie skłaniają one ku diagnostyce. Jak widać w poprzednim akapicie, objawy białaczki nie są charakterystyczne. Gorączka i bladość są częste u dzieci (u których dominują choroby zakaźne), jednak każda wątpliwość w ocenie przyczyn objawów powinna stanowić wskazanie do oznaczenia morfologii z rozmazem.
Z uwagi na szerokie spektrum innych możliwych objawów, diagnostyka może być bardzo szeroka, z oznaczeniem m.in. CRP, ALT, AST, kwasu moczowego, LDH, kreatyniny, glukozy, a w przypadku powiększenia węzłów chłonnych także przeciwciał w klasie IgM i IgG w kierunku zakażenia EBV, CMV i toksoplazmozy.

Jak przebiega leczenie białaczki u dzieci?
Terapia różni się znacznie w zależności od podtypu białaczki i współistnienia innych czynników ryzyka. W większości przypadków opiera się jednak na chemioterapii, coraz częściej uzupełnianej immunoterapią (przeciwciałami „wycelowanymi” w punkt, który utrudnia i/lub uniemożliwia namnażanie się komórkom nowotworowym).
W przewlekłej białaczce szpikowej oraz niektórych rodzajach białaczek ostrych cenną opcją terapeutyczną jest przeszczep szpiku kostnego. Ogółem rokowanie jest pomyślne, gdyż jak wspomniano, wyleczonych zostaje około 90% dzieci.
Wiele zależy od poszczególnego rodzaju białaczki, obecności niektórych mutacji w obrębie komórek nowotworowych, a także czasu rozpoznania. Im wcześniej choroba zostanie wykryta, tym większa szansa na sukces terapeutyczny.
Czy białaczce można zapobiec?
Dane literaturowe na ten temat są stosunkowo ubogie, jednak ich liczba rośnie i znaczna większość wskazuje na pewien trend. Zbiorcze analizy przeprowadzone przez Childhood Leukemia International Consortium wykazały zwiększone ryzyko ALL i AML u dzieci w związku z ekspozycją na pestycydy przed i po urodzeniu.
Przybywa coraz więcej silnych dowodów potwierdzających zwiększenie ryzyka ALL u dzieci, których ojcowie są czynnymi palaczami oraz matek sięgających po nikotynę w okresie laktacji. Zwiększone ryzyko ALL i AML u dzieci istnieje także w wyniku narażenia na farby i rozpuszczalniki w domu lub miejscu pracy rodziców.
Ostatnie metaanalizy wykazały istotny, 1,5-krotny wzrost ryzyka białaczki u dzieci w związku z różnymi zanieczyszczeniami powietrza, głównie benzenem i dwutlenkiem azotu. Idąc w drugą stronę – dobrze udokumentowano fakt, iż zmniejszenie ryzyka białaczki uzyskuje się dzięki karmieniu piersią, o 10 i 20% w przypadku kobiet karmiących piersią przez 6 miesięcy i dłużej.
>>Przeczytaj: Rola badań genetycznych w diagnostyce nowotworów
Białaczka u dzieci – podsumowanie
Białaczka to najczęstszy nowotwór złośliwy u dzieci i młodzieży. Jego objawy są niecharakterystyczne i pokrywają się z tymi obserwowanymi w przypadku innych chorób wieku dziecięcego. Podejrzenie białaczki powinno skłonić do oznaczenia (co najmniej) morfologii krwi z rozmazem. Odpowiednio wczesne rozpoznanie umożliwia szybkie znalezienie się w ośrodku referencyjnym, gdzie zostanie włączone leczenie. W większości przypadków rokowanie jest dobre. W dużej mierze zależy ono od typu białaczki oraz obecności określonych mutacji w komórkach nowotworowych.
Źródła:
- Childhood Leukemia: A Preventable Disease – PMC
- Childhood Leukemia and Primary Prevention – PMC
- Infection and childhood leukemia: review of evidence – PMC
- Leukemia – StatPearls – NCBI Bookshelf
- Acute Lymphocytic Leukemia – StatPearls – NCBI Bookshelf
- Pediatric AML: From Biology to Clinical Management – PMC
- Chronic Lymphocytic Leukemia – StatPearls – NCBI Bookshelf
- Topics in Pediatric Leukemia – Acute Myeloid Leukemia – PMC
- Childhood Chronic Myeloid Leukemia (CML) | Dana-Farber Cancer Institute