Choroba Chagasa to schorzenie pasożytnicze, które występuje w pewnych rejonach świata, stanowiąc tym samym zagrożenie dla wielu osób podróżujących. Choroba ta może przebiegać w sposób zupełnie bezobjawowy, ale również prowadzić do poważnych powikłań zdrowotnych. Gdzie występuje choroba Chagasa i jaki jest jej obraz kliniczny? W jaki sposób może dojść do zakażenia? Jak chronić się przed chorobą Chagasa?
Spis treści:
- Co to jest choroba Chagasa?
- Świdrowiec amerykański – główny winowajca choroby Chagasa
- Gdzie występuje choroba Chagasa?
- Jakie objawy daje choroba Chagasa?
- Diagnostyka trypanosomozy
- Leczenie trypanosomozy
Co to jest choroba Chagasa?
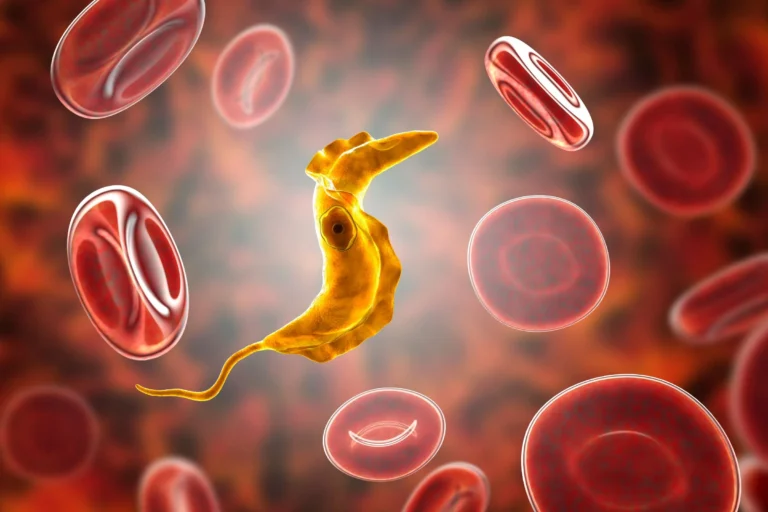
Choroba Chagasa, nazywana także trypanosomozą amerykańską to jedna z chorób pasożytniczych, która występuje w sposób endemiczny, czyli danym obszarze w podobnej liczbie przypadków przez wiele lat. Choć w większości przypadków choroba Chagasa przebiega w sposób bezobjawowy, to przy wystąpieniu pewnych powikłań może doprowadzić do zgonu. Jaka jest przyczyna choroby Chagasa? Odpowiedź znajdziemy w kolejnych akapitach tego artykułu.
Świdrowiec amerykański – główny winowajca choroby Chagasa
Przyczyną choroby Chagasa jest wewnątrzkomórkowy pierwotniak Trypanosoma cruzi (świdrowiec amerykański), który cechuje się dużym powinowactwem do komórek układu nerwowego, a także komórek mięśniowych, w tym mięśnia sercowego.
Rezerwuarem tego pierwotniaka są domowe i dzikie zwierzęta, przede wszystkim gryzonie. Jak więc dochodzi do zakażenia? Pasożyt odpowiedzialny za chorobę Chagasa jest przenoszony przez tak zwane „pluskwy całujące” (czyli pluskwiaki z rodzaju Triatoma, Rhodnius, a także Panstrongylus). Tego rodzaju pluskwy są aktywne głównie nocą, a do zarażenia dochodzi przede wszystkim na skutek kontaktu wydalin pluskwiaków z uszkodzoną skórą człowieka, rzadziej przez samo ukąszenie.
Do zarażenia może dojść także poprzez spożywanie soków owocowych lub z trzciny cukrowej, zanieczyszczonej kałem pluskwiaków. Inne, możliwe drogi zarażenia to przetoczenia krwi i preparatów krwiopochodnych, przeszczepy serca (gdy doszło do zainfekowania jego komórek) oraz droga przezłożyskowa.
Gdzie występuje choroba Chagasa?
W jakich rejonach można spodziewać się występowania choroby Chagasa? Należy tutaj wymienić przede wszystkim tereny wiejskie i rolnicze w Ameryce Środkowej i Ameryce Południowej oraz w niektórych, południowych stanach USA. Na szczególną uwagę zasługują doliny górskie, występujące w Andach. Choroba ta występuje też w Hiszpanii i Portugalii, co wynika z ruchów migracyjnych i pojawiania się emigrantów z Ameryki Południowej. Warto zaznaczyć, że schorzenie jest przekazywane przez łożysko, co sprawia, że występuje w kolejnych pokoleniach migrujących osób.
Jakie objawy daje choroba Chagasa?
Trypanosomoza może mieć bardzo różny przebieg kliniczny – od bezobjawowego do bardzo ciężkiego. Pierwsze objawy choroby Chagasa pojawiają się najczęściej po upływie 2 tygodni od zarażenia. Jakie są pierwsze objawy trypanosomozy? Należy tutaj wymienić:
- obrzęk i pojawienie się owrzodzenia w miejscu wniknięcia pasożyta przez skórę,
- obrzęk w obrębie spojówek, obrzęk połowy twarzy – dotyczy to sytuacji, gdy do wniknięcia doszło poprzez spojówkę oka,
- gorączka,
- ból mięśni,
- osłabienie,
- powiększenie węzłów chłonnych,
- zmiany skórne,
- powiększenie wątroby i śledziony ,
- objawy zapalenia mięśnia sercowego,
- zapalenie mózgu i opon mózgowo-rdzeniowych.
W sytuacji braku włączenia leczenia parazyty utrzymują się we krwi pacjenta przez wiele lat, co skutkuje pojawieniem się objawów związanych z przewlekłym przebiegiem schorzenia. Po kilku, kilkunastu latach mogą pojawić się takie powikłania choroby jak:
- kardiomiopatia rozstrzeniowa,
- zaburzenia rytmu serca,
- poszerzenie przewodu pokarmowego,
- zapalenie mięśnia sercowego,
- zapalenie mózgu.
Diagnostyka trypanosomozy
Jakie badania pozwalają na postawienie diagnozy i rozpoznanie choroby Chagasa? W trakcie diagnostyki trypanosomatozy wykonuje się głównie:
- badanie mikroskopowe preparatu grubej kropli krwi,
- gruby i cienki rozmaz krwi obwodowej w kierunku obecności postaci trypomastigota,
- hodowlę na specjalnych podłożach (Novy-MacNeal-Nicolle),
- badanie histologiczne materiału pobranego z węzłów chłonnych, szpiku lub śledziony lub innego narządu w kierunku obecności Trypanosoma cruzi,
- wykrywanie swoistych przeciwciał IgM i IgG we krwi obwodowej z wykorzystaniem techniki ELISA,
- wykrywanie DNA Trypanosoma cruzi z wykorzystaniem techniki PCR we krwi obwodowej lub materiale tkankowym, pobranym drogą biopsji.
Badania pomocnicze, które wykonywane są w trakcie diagnozowania tego schorzenia to przede wszystkim:
- parametry stanu zapalnego – czyli stężenie CRP i prokalcytoniny,
- badanie RTG klatki piersiowej, w którym można uwidocznić powiększenie sylwetki serca,
- echokardiografia – pozwala na zobrazowanie poszerzenia jam serca oraz pogrubienia jego ścian,
- elektrokardiografia (EKG) – pozwala na zobrazowanie i potwierdzenie obecności zaburzeń rytmu serca,
- badania obrazowe przewodu pokarmowego – pozwalają na zobrazowanie poszerzenia przewodu pokarmowego.
Leczenie trypanosomozy
Sposób leczenia choroby Chagasa zależy przede wszystkim od okresu zakażenia. W ostrym okresie stosuje się przede wszystkim leki przeciwpasożytnicze, takie jak nifurtimoks i benznidazol. Jednak w momencie występowania przewlekłego okresu choroby leczenie przeciwpasożytnicze nie jest już skuteczne. W tym okresie ważne jest leczenie powikłań narządowych choroby, a więc:
- leczenie przewlekłej niewydolności serca,
- włączenie terapii przeciwkrzepliwej,
- leczenie zaburzeń rytmu serca,
- implantacja stymulatora serca,
- leczenie zaburzeń perystaltyki przewodu pokarmowego,
- terapia powikłań neurologicznych,
- w zaawansowanych przypadkach nawet transplantacja serca.
Podsumowując, choroba Chagasa to schorzenie pasożytnicze, które w wielu przypadkach przebiega bezobjawowo, jednak może również doprowadzić do poważnych powikłań, w tym do zgonu włącznie. Jest to choroba, której nie możemy zapobiegać poprzez szczepienia ochronne. Warto jednak chronić się przed kontaktem z pluskwiakami na terenach endemicznego występowania choroby Chagasa w inny sposób – na przykład poprzez unikanie noclegu w budynkach, gdzie mogą występować pluskwiaki oraz przez rozpylanie w pobliżu zabudowań mieszkalnych insektycydów je odstraszających. Warto dodać, że wczesne wykonanie badań diagnostycznych pozwala na szybkie postawienie diagnozy, a tym samym zwiększenie skuteczności leczenia przeciwpasożytniczego.
Bibliografia
- S. Dubner, Choroba Chagasa — aktualny stan wiedzy na temat rozpoznawania i postępowania terapeutycznego, Folia Cardiologica Excerpta 2009, tom 4, nr 6, 330–344,
- P. Gajewski, Interna Szczeklika. Podręcznik chorób wewnętrznych, Medycyna Praktyczna, Kraków 2019/2020,
- H. A. Corbucci, QT interval dispersion in patients with chronic heart failure secondary to Chagas’ cardiomyopathy: correlation with clinical variables of prognostic significance. Cardiovasc. Pathol. 2006; 15: 18–23.