Borelioza jest chorobą, która występuje coraz powszechniej – liczba pacjentów leczonych z powodu tej choroby rośnie. Niestety w diagnostyce i leczeniu zdarzają się błędy. Funkcjonuje również dużo mitów, które są szkodliwe dla rozpoznania boreliozy. Artykuł skupia się na wyjaśnieniu tych pułapek – zapraszamy do lektury!
Spis treści:
- Najczęstsze pułapki w diagnostyce boreliozy
- Stawianie rozpoznania tylko na podstawie wyników badań serologicznych
- Niepełna diagnostyka serologiczna
- Wykonywanie badań serologicznych celem potwierdzenia rozpoznania rumienia wędrującego
- Borelioza stawowa – nieprawidłowe rozpoznanie
- Ocena skuteczności leczenia i monitorowanie terapii przy pomocy testów serologicznych
- Najczęstsze błędy w leczeniu boreliozy
- Błędy w diagnostyce boreliozy – podsumowanie
Najczęstsze pułapki w diagnostyce boreliozy
Diagnostyka boreliozy jest zagadnieniem szczegółowo opisanym w medycznych rekomendacjach. Postępowanie zgodne z tymi rekomendacjami – czyli diagnostyka dwuetapowa oraz rozpoznawanie choroby nie tylko na podstawie badań serologicznych – ułatwia postawienie diagnozy, zarówno potwierdzającej chorobę, jak i ją wykluczającej.
>> Więcej informacji na temat boreliozy, jej objawów i etapów diagnozowania znajdziesz w artykule: Borelioza – objawy, etapy i diagnostyka w ALAB
Najczęstsze pułapki w diagnostyce boreliozy to:
Stawianie rozpoznania tylko na podstawie wyników badań serologicznych
Wynik badania serologicznego i istnienie przeciwciał IgM czy IgG nie może być podstawą do rozpoznania aktywnej choroby i wdrożenia leczenia. Dlaczego? Borelioza jest chorobą wywoływaną przez bakterię Borrelia burgdorferi. W wyniku kontaktu z tą bakterią w organizmie człowieka dochodzi do uruchomienia odpowiedzi immunologicznej. Organizm broni się przed infekcją, wytwarzając przeciwciała. Mechanizm tej odpowiedzi jest analogiczny jak w przypadku innych chorób wywoływanych przez bakterie czy wirusy, gdzie dodatni wynik badania serologicznego jest tylko informacją o tym, że mieliśmy kontakt z określonym patogenem. Aby rozpoznać boreliozę, konieczne jest występowanie objawów choroby razem z pozytywnym wynikiem testu.
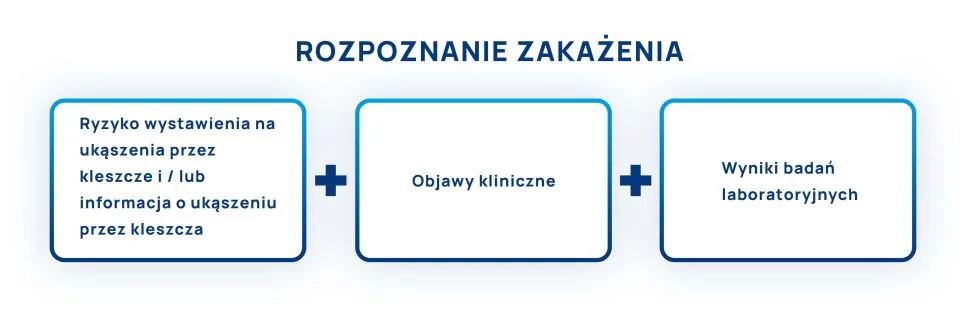
- Ocena ryzyka ekspozycji na kleszcze. Pierwszy etap to dokładna ocena ryzyka ekspozycji na kleszcze. Należy wziąć pod uwagę historię pacjenta, w tym czas spędzony w obszarach, gdzie kleszcze są powszechne oraz sezonową aktywność tych pasożytów.
- Analiza objawów klinicznych. Drugi krok to szczegółowa analiza objawów klinicznych. Lekarze muszą identyfikować symptomy sugerujące boreliozę, takie jak wysypka w miejscu ukąszenia, bóle stawów, gorączka, czy inne specyficzne dla choroby znaki.
- Interpretacja wyników badań laboratoryjnych. Trzeci i ostatni etap to interpretacja wyników badań laboratoryjnych. Testy te mogą wykazać obecność przeciwciał przeciwko Borrelia spp, co w połączeniu z oceną ryzyka i objawów klinicznych, jest kluczowe dla postawienia diagnozy.
Okazuje się, że ok. 3-15% zdrowych mieszkańców Europy posiada przeciwciała przeciwko tym patogenom. Ich obecność stwierdza się u 5% zdrowych dawców krwi oraz aż u 50% zdrowych pracowników leśnych. U tych wszystkich osób powstaje skuteczna odpowiedź immunologiczna, dzięki której nie dochodzi do rozwoju choroby. Inną przyczyną zakażenia bezobjawowego może być niewielka ilość bakterii w organizmie pacjenta – wystarczająca do wywołania produkcji przeciwciał, ale zbyt mała, aby doprowadzić do choroby.
Niepełna diagnostyka serologiczna
Diagnostyka serologiczna boreliozy jest dwuetapowa. Obejmuje test ELISA oraz – w drugim etapie – testy WESTERN BLOT.
>> Więcej informacji na temat rozpoznania boreliozy znajdziesz tutaj: Diagnostyka boreliozy – pytania i odpowiedzi – ALAB Laboratoria
Czasem pacjenci zastanawiają się, który test na boreliozę wybrać – ELISA, czy WESTERN-BLOT. Zdarza się, że wykonują tylko drugi etap badań, ponieważ uważają, że test WESTERN-BLOT jest „lepszy” i bardziej wiarygodny. Otóż obydwa testy są wiarygodne! Żaden z nich nie jest „lepszy”, ponieważ są to dwa badania, które – jeśli zachodzi taka potrzeba – powinno się wykonywać jeden po drugim, w określonej kolejności.

Test ELISA jest pierwszym etapem w rozpoznawaniu boreliozy. Jeśli jest ujemny i pacjent nie ma objawów klinicznych charakterystycznych dla choroby, nie wykonuje się dalszych badań serologicznych. Natomiast jeśli test ELISA jest dodatni, kolejnym krokiem jest test potwierdzający chorobę, czyli WESTERN BLOT.

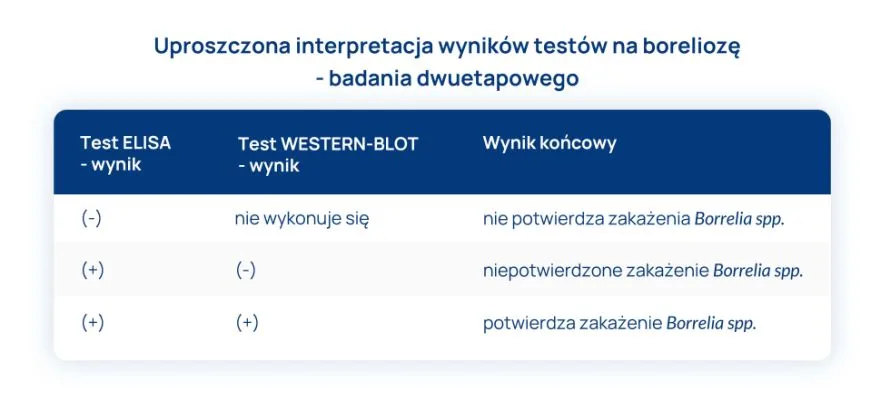
Co oznacza dodatni wynik testu ELISA? Oto uproszczona interpretacja:
- poziom przeciwciał przeciwko antygenom Borrelia spp jest wysoki i jest to wynik charakterystyczny dla osoby zakażonej – test ELISA jest bowiem testem półilościowym, o wysokiej czułości;
- konieczne jest wykonanie badania metodą WESTERN-BLOT, które może sprawdzić, czy wśród obecnych przeciwciał są tylko te, związane z Borrelia spp, czy również takie, które są wspólne dla z Borrelia spp i innych bakterii (przeciwciała przeciwko flagelinie, które są niespecyficzne dla Borrelia spp.
Jak interpretować ujemny wynik testu ELISA?
dalsze badania serologiczne nie są konieczne, ponieważ nie potwierdza się zakażenie bakterią Borrelia spp.
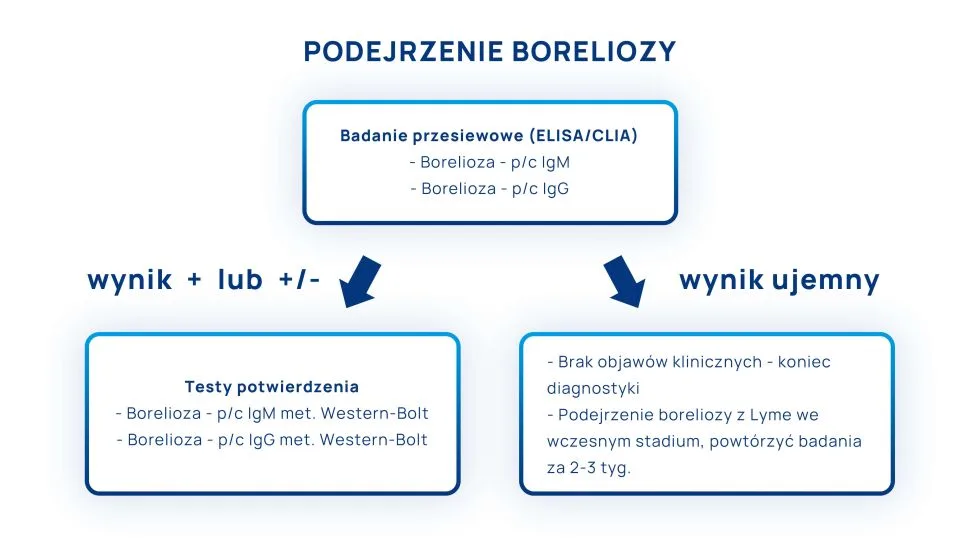
Jeśli zostanie zachowana odpowiednia kolejność testowania, a interpretacja wyników będzie spójna z objawami, które odczuwa pacjent, rozpoznanie boreliozy będzie wiarygodne. Kolejny krok to wdrożenie odpowiedniego leczenia.
Wykonywanie badań serologicznych celem potwierdzenia rozpoznania rumienia wędrującego
Rumień wędrujący to charakterystyczna zmiana skórna, która pojawia się po ugryzieniu przez kleszcza i stanowi sygnał boreliozy. W przypadku wystąpienia tego objawu, nie ma konieczności przeprowadzania dodatkowych testów laboratoryjnych, aby potwierdzić zakażenie.
Rumień po kleszczu jest najczęstszym objawem boreliozy spośród wszystkich wczesnych manifestacji choroby. Pojawia się dosyć szybko i może być widoczny już po 5 dniach od ukąszenia przez kleszcza. Tymczasem przeciwciała pojawiają się najwcześniej po ok. 2 tygodniach, a czasem trwa to nawet 6-8 tygodni. Ponadto u niektórych pacjentów chorych na boreliozę przeciwciała w ogóle się nie pojawią. Szacuje się, że dotyczy to nawet 30% chorych. Dlatego klasyczny rumień wędrujący jest wskazaniem do wdrożenia antybiotykoterapii. Czasem pacjenci zgłaszają się do nas z wątpliwościami: „wystąpił u mnie rumień po kleszczu, co robić?”. Odpowiedź jest jednoznaczna – należy iść do lekarza, który wdroży antybiotykoterapię.
Borelioza stawowa – nieprawidłowe rozpoznanie
Borelioza stawowa charakteryzuje się określonymi objawami. Najczęściej zajęte są duże stawy – u 70-90% pacjentów jest to kolano, a następny w kolejności jest staw łokciowy. Początek dolegliwości jest dosyć gwałtowny, a ból (kolana lub łokcia) nasila się przy obciążaniu kończyny. Dolegliwości bólowe w kolanie są odczuwalne, na przykład przy wchodzeniu lub schodzeniu ze schodów lub w czasie marszu.
Częste pytanie, które lekarz słyszy od pacjenta brzmi: „jak odróżnić boreliozę od RZS (reumatoidalnego zapalenia stawów)?”. Otóż obraz choroby jest w obydwu przypadkach różny. Jak wspomniano wyżej w boreliozie stawowej zajęte są duże stawy (jeden lub dwa) a ból nasila się przy obciążaniu kończyn. Dla RZS charakterystyczne jest symetryczne zajęcie małych stawów dłoni i stóp, a dolegliwościom bólowym towarzyszy sztywność poranna.
Ocena skuteczności leczenia i monitorowanie terapii przy pomocy testów serologicznych
Kolejne pytanie, jakie lekarze często słyszą od pacjentów, brzmi: „kiedy należy wykonać testy na boreliozę po zakończeniu terapii antybiotykiem?”. Odpowiedź na to pytanie jest jednoznaczna – nie wykonuje się badań przeciwciał IgG czy IgM po zakończeniu leczenia, ponieważ mogą one utrzymywać się w krwi chorego przez lata. Przeciwciała w klasie IgG są obecne przez wiele lat po przebytej infekcji, również po leczeniu antybiotykiem. Swoiste przeciwciała IgM również mogą utrzymywać się długo, nawet przez kilka lat. Dlatego nie można wykorzystywać testów serologicznych do oceny skuteczności terapii i nie ma sensu ich wówczas wykonywać.
Najczęstsze błędy w leczeniu boreliozy
Najczęstsze błędy wynikają z niedostatecznej wiedzy na temat tej choroby oraz z nieprawidłowej diagnostyki. Oto typowe pomyłki w leczeniu boreliozy:
Stosowanie nieodpowiednich antybiotyków
Leczenie boreliozy wymaga zastosowania odpowiednich antybiotyków zgodnie z zalecanym w rekomendacjach okresem leczenia. Wytyczne dopuszczają cztery antybiotyki, które mogą być zastosowane w leczeniu boreliozy:
- doksycylina
- amoksycylina
- cefuroksym
- ceftriakson.
Każdy z antybiotyków jest wybierany w zależności od stadium choroby, wieku pacjenta oraz potencjalnych przeciwwskazań.
Stosowanie antybiotyków na boreliozę zbyt krótko lub zbyt długo
Jak długo należy brać antybiotyk na boreliozę? Wytyczne rekomendują stosowanie leków na boreliozę przez 14-28 dni w zależności od występujących objawów i ich nasilenia. W przypadku rumienia stosuje się antybiotyk przez 14-21 dni.
Należy pamiętać, że dłuższe stosowanie antybiotyków wywołuje działania niepożądane, np. uszkodzenie wątroby, zmiany w morfologii krwi, biegunki, czy dysbiozę. Zbyt długie przyjmowanie antybiotyków na boreliozę nie przynosi natomiast poprawy w zakresie zgłaszanych dolegliwości.
Pacjent powinien mieć również świadomość, iż możliwe jest utrzymywanie się objawów już po zakończeniu antybiotykoterapii. Nawet 25% chorych odczuwa łagodne objawy zapalenia stawów jeszcze przez kilka miesięcy po ukończeniu leczenia.
Stosowanie nieodpowiednich dawek antybiotyków
Stosowanie nieodpowiednich dawek antybiotyków w leczeniu boreliozy może prowadzić do szeregu negatywnych konsekwencji. Zbyt niskie dawki mogą nie zapewnić efektywnej eliminacji bakterii Borrelia spp, co zwiększa ryzyko nawrotu choroby i jej przewlekłego przebiegu. Z kolei zbyt wysokie dawki mogą wywołać niepożądane efekty uboczne, w tym toksyczność dla organizmu, szczególnie w przypadku długotrwałego stosowania. Dlatego tak ważne jest, aby lekarze przestrzegali aktualnych rekomendacji dotyczących dawkowania antybiotyków w leczeniu boreliozy, które są oparte na najnowszych badaniach klinicznych i danych epidemiologicznych.
Błędy w diagnostyce boreliozy – podsumowanie
Borelioza jest chorobą, która – jeśli jest właściwie zdiagnozowana i właściwie leczona – jest w pełni wyleczalna. Należy pamiętać, że jej rozpoznanie nie może być postawione wyłącznie na podstawie badań serologicznych, ponieważ istnienie przeciwciał świadczy o kontakcie z patogenem, ale nie przesądza o aktywnym zakażeniu.
Diagnostyka laboratoryjna boreliozy jest dwustopniowa. W celu potwierdzenia zakażenia wynik badania ELISA i WESTERN BLOT muszą być dodatnie. Aby skutecznie wyleczyć boreliozę należy wdrożyć odpowiednie antybiotyki, w odpowiednich dawkach i przez zalecany przez rekomendacje czas. Przedłużanie leczenia jest bezzasadne, naraża pacjenta na działania niepożądane i nie przynosi poprawy klinicznej.
Bibliografia:
- Moniuszko-Malinowska A., Pancewicz S., Czupryna P. i wsp.: Zalecenia diagnostyki i leczenia boreliozy z Lyme Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych. Med. Prakt., 2023; 12: 66–80, 92;
- Czarnecki M., Borelioza – najczęstsze błędy diagnostyczne i terapeutyczne, wykład konferencja „Choroby odkleszczowe” 18.04.2024.