Poronienie jest jednym z najtrudniejszych doświadczeń, jakie mogą spotkać przyszłych rodziców. Chociaż jest to zjawisko stosunkowo częste, ponieważ dotyka około 15-20% wszystkich ciąż, każdy przypadek niesie za sobą głęboki smutek i mnóstwo pytań. Odpowiedzi na niektóre z tych pytań mogą być zawarte w wynikach badań przeprowadzanych po poronieniu, co może przyczynić się do lepszego przygotowania i opieki w kolejnych próbach zajścia w ciążę.
Spis treści:
- Czym jest poronienie?
- Jakie badania zrobić po poronieniach?
- Dlaczego warto wykonywać badania po poronieniach?
W tym artykule omówimy, jakie badania warto przeprowadzić po poronieniu, aby uzyskać jasny obraz sytuacji oraz jakie korzyści wynikają z ich wykonania. Zapraszamy do lektury, która mamy nadzieję, okaże się pomocna i rzuci więcej światła na ten delikatny temat.
Czym jest poronienie?
Poronienie samoistne to utrata ciąży przed 22 tygodniem ciąży, co zazwyczaj wynika z naturalnych, często nieprzewidywalnych przyczyn. Jest to zjawisko dość powszechne, które dotyka około 15-20% wszystkich ciąż. Chociaż przyczyny mogą być różne, najczęściej są związane z nieprawidłowościami genetycznymi płodu.
Istnieje wiele czynników, które mogą prowadzić do poronienia samoistnego. Do najczęstszych należą:
– anomalie dotyczące liczby i struktury chromosomów płodu,
– zmiany cytogenetyczne u rodziców,
– wady rozwojowe, takie jak puste jajo płodowe czy zaśniad,
– wady anatomiczne macicy kobiety ciężarnej, takie jak wrodzone wady macicy (np. przegroda macicy), zrosty w obrębie macicy, czy obecność mięśniaków,
– zaburzenia hormonalne, takie jak zbyt mała produkcja progesteronu – hormonu kluczowego dla utrzymania ciąży oraz zaburzenia hormonalne tarczycy,
– chroniczny stres,
– choroby autoimmunologiczne, np. zespół antyfosfolipidowy czy toczeń rumieniowaty układowy;
– choroby zakaźne, jak toksoplazmoza i niektóre choroby weneryczne,
– choroby przewlekłe, takie jak cukrzyca, nadciśnienie oraz zaburzenia krzepnięcia – w przypadku, gdy nie są odpowiednio leczone,
– stosowanie niektórych leków, np. niesteroidowych leków przeciwzapalnych (NLPZ) czy retinoidów,
– nieprawidłowy styl życia: spożywanie alkoholu, palenie tytoniu, czy używanie narkotyków.
Jeśli ciąża samoistnie kończy się poronieniem przynajmniej trzy razy z rzędu, mówimy o poronieniach nawykowych lub nawracających, przy czym najczęstszą przyczyną są czynniki genetyczne.
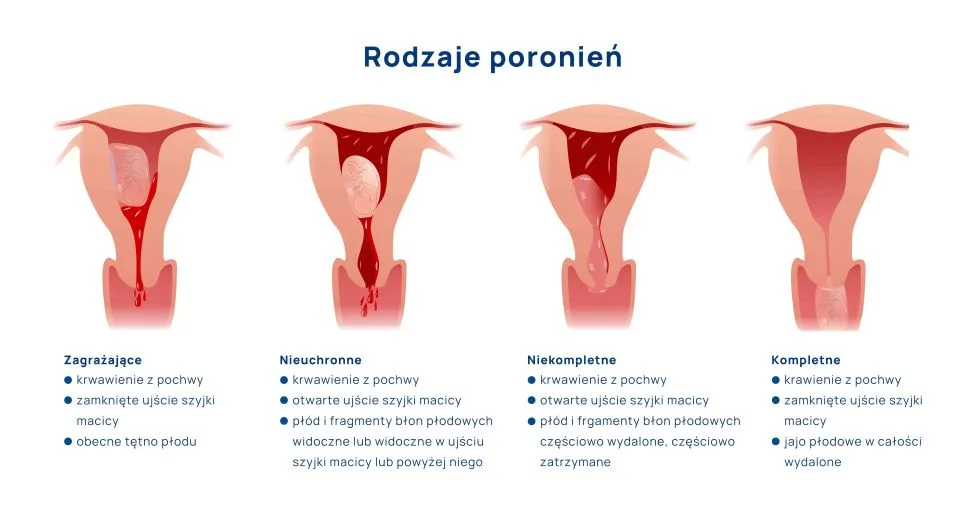
Jakie badania zrobić po poronieniach?
Po doświadczeniu poronienia, wielu lekarzy zaleca przeprowadzenie serii badań, aby zrozumieć potencjalne przyczyny i zaplanować dalsze kroki w przyszłych próbach zajścia w ciążę. Badania te mogą pomóc wyjaśnić, czy przyczyny poronienia są jednorazowe czy mogą powtarzać się w przyszłości, co jest kluczowe dla par starających się o dziecko.
Badania histopatologiczne po poronieniu
Badanie histopatologiczne to podstawowe badanie, polegające na mikroskopowej analizie tkanki pobranej po poronieniu. Pozwala ono ocenić, czy tkanki płodu i łożyska wykazywały jakiekolwiek nieprawidłowości strukturalne lub patologiczne, które mogły przyczynić się do poronienia. Może to obejmować zmiany zapalne, zaburzenia krążenia w łożysku, czy nieprawidłowości w budowie komórek.
Badania genetyczne płodu po poronieniach
Nieprawidłowości chromosomalne są uważane za jedną z głównych przyczyn poronień. Badania genetyczne, takie jak ustalenie kariotypu zarodka/płodu, umożliwiają identyfikację nieprawidłowości genetycznych. Dzięki tym informacjom, para może zrozumieć, czy przyczyna poronienia była przypadkowa, czy też może istnieć ryzyko powtórzenia się w kolejnych ciążach.

>>> Przeczytaj też: Kariotyp – badanie genetyczne
Badania genetyczne rodziców po poronieniach
Przyczyny poronień często wynikają z nieprawidłowości genetycznych u rodziców. Mogą one obejmować na przykład zrównoważone translokacje chromosomowe, w których fragmenty chromosomów są „zamienione miejscami” lub „obrócone”, nie wpływając na zdrowie rodzica, ale potencjalnie prowadząc do nieprawidłowości genetycznych u potomstwa i tym samym do poronienia. Również mutacje pojedynczych genów związanych z zaburzeniami krzepliwości krwi czy układem immunologicznym, a także zjawisko polimorfizmu pojedynczych nukleotydów mogą zwiększać ryzyko poronień.
Dodatkowo, anomalie genetyczne, takie jak mozaicyzm gonadalny, mogą być niewykrywalne u rodzica, ale wpływać na zdrowie reprodukcyjne. Dla zidentyfikowania tych czynników, zalecane są badania genetyczne, takie jak kariotypowanie, czy bezpośrednie sekwencjonowanie DNA, które mogą pomóc w zaplanowaniu odpowiednich działań, w tym doradztwa genetycznego czy technik wspomaganego rozrodu z selekcją genetyczną embrionów (PGD/PGS).
Badania immunologiczne po poronieniach
Niekiedy układ immunologiczny matki może błędnie identyfikować ciążę jako zagrożenie, co prowadzi do odrzucenia płodu. Badania immunologiczne, identyfikują potencjalne anomalie w układzie odpornościowym matki, które mogą zakłócać prawidłowy rozwój ciąży. Należy tutaj wymienić przede wszystkim obecność przeciwciał antykardiolipinowych i antyfosfolipidowych związanych z zespołem antyfosfolipidowym, przeciwciał antyjądrowych wskazujących na choroby autoimmunologiczne takie jak toczeń, oraz nieprawidłowe poziomy cytokin, które mogą prowadzić do odrzucenia tkanki płodowej.
Dodatkowo, analiza komórek NK (Natural Killer) oraz panel przeciwciał przeciwplemnikowych mogą ujawnić mechanizmy immunologiczne utrudniające proces zapłodnienia i rozwój zarodka. Badania zgodności tkankowej między partnerami również mogą być rozważane, aby sprawdzić, czy nadmierna zgodność genetyczna nie wpływa na odrzucenie zarodka przez układ odpornościowy kobiety. Wyniki tych badań mogą wskazywać na konieczność zastosowania terapii immunosupresyjnych, leków przeciwzakrzepowych czy innych interwencji mających na celu regulację odpowiedzi immunologicznej, co jest istotne dla prowadzenia przyszłych ciąż i minimalizacji ryzyka kolejnych poronień.
Badania hormonalne po poronieniach
Badania hormonalne po poronieniach są kluczowym elementem diagnostycznym, umożliwiającym ocenę równowagi hormonalnej, która odgrywa fundamentalną rolę w regulacji procesów rozrodczych, takich jak owulacja, implantacja zarodka, i utrzymanie ciąży. Wśród zalecanych badań znajduje się ocena poziomu progesteronu, niezbędnego do utrzymania ciąży, estradiolu regulującego cykl menstruacyjny, hormonu folikulotropowego (FSH) i luteinizującego (LH), które stymulują wzrost i dojrzewanie komórek jajowych, oraz prolaktyny, która choć głównie związana z laktacją, może wpływać na owulację.
Ponadto, ważne są badania hormonów tarczycy (TSH, fT3, fT4), które wpływają na ogólny metabolizm i zdrowie reprodukcyjne, a także oznaczenie testosteronu i innych androgenów, które mogą zaburzać funkcje jajników. Hormon antymüllerowski (AMH) może być badany w celu oceny rezerwy jajnikowej.
Badania krwi po poronieniach
Badania krwi mogą wykryć inne potencjalne przyczyny poronień, takie jak nieleczona cukrzyca, problemy z krzepnięciem krwi (np. zespół antyfosfolipidowy), czy ukryte infekcje, które mogły wpłynąć na zdrowie płodu lub matki. Badania krwi mogą również obejmować ocenę ewentualnych niedoborów witamin i mikroelementów , takich jak witamina D , czy żelazo, które także mogą wpływać na przebieg ciąży.
Dlaczego warto wykonywać badania po poronieniach?
Przeprowadzenie wskazanych badań po poronieniu jest niezwykle ważne, ponieważ dostarcza kluczowych informacji o możliwych przyczynach problemów z utrzymaniem ciąży. Dzięki temu lekarze mogą lepiej doradzić parom w planowaniu przyszłych ciąż oraz potencjalnie zaproponować odpowiednie leczenie lub interwencje, które zwiększą szanse na zdrową ciążę. Ponadto, zrozumienie przyczyn poronień może pomóc w emocjonalnym odbudowaniu się po stracie i przygotowaniu do kolejnych prób zajścia w ciążę. Wiedza ta może również przyczynić się do lepszego monitorowania każdej następnej ciąży, zwiększając jej bezpieczeństwo i prawdopodobieństwo donoszenia zdrowego dziecka.
Opieka merytoryczna: lek. Katarzyna Banaszczyk
>> Dowiedz się więcej na temat diagnostyki niepłodności
Bibliografia
- https://www.mp.pl/pacjent/ciaza/przebiegciazy/90964,poronienie
- Branch W., Gibson M., M. Silver R. Poronienia nawracające. N Engl J Med 2010;363: s. 1740-47.
- Alsibiani SA. Value of histopathologic examination of uterine products after first-trimester miscarriage. Biomed Res Int. 2014;2014:863482. doi: 10.1155/2014/863482. Epub 2014 Jun 26.
- Bottomley C., Bourne T. Diagnosing miscarriage. Best Practice & Research Clinical Obstetrics & Gynaecology, Volume 23, Issue 4, 2009, Pages 463-477, ISSN 1521-6934.
- Garrido-Gimenez C., Alijotas-Reig J. Recurrent miscarriage: causes, evaluation and management. Postgraduate Medical Journal, Volume 91, Issue 1073, March 2015, Pages 151–162.