Borelioza, czyli choroba z Lyme, to najczęstsza choroba odkleszczowa w Polsce. Początkowe objawy boreliozy mogą przypominać infekcję wirusową. Wówczas, aby potwierdzić zakażenie, należy wykonać badania laboratoryjne. Istnieje jednak przypadek, gdy wykonywanie badań laboratoryjnych w celu postawienia diagnozy tej choroby jest niepotrzebne. Jest to sytuacja, gdy u pacjenta po ukąszeniu kleszcza wystąpi rumień wędrujący. Jak rozpoznać rumień? Czym rumień wędrujący różni się od innych tego typu objawów? Zapraszamy do lektury!
Spis treści:
- Rumień wędrujący – co to jest?
- Rumień wędrujący po ukąszeniu kleszcza – jakie kroki podjąć? Leczenie rumienia wędrującego
- Rumień wędrujący – podsumowanie
Rumień wędrujący – co to jest?
Rumień wędrujący (Erythema migrans) jest zmianą skórną, która pojawia się u ok. 80% chorych po ukłuciu przez kleszcza. Jest to pewny objaw boreliozy – jego wystąpienie zwalnia z wykonywania badań laboratoryjnych. Rumień wędrujący zaliczamy do objawów boreliozy wczesnej. Uwidacznia się w ciągu 3-30 dni od kontaktu z pajęczakiem.
Jak wygląda rumień wędrujący? Zdjęcia i opisy
Rumień po ukąszeniu kleszcza jest rozszerzającą się zmianą skórną o średnicy powyżej 5 cm. Jeśli rumień pojawi się wcześniej niż 3 dni lub później niż 30 dni po ukąszeniu kleszcza, to najprawdopodobniej nie jest to borelioza. Zmiana skórna może być jedynym objawem tej choroby. Może także współistnieć z objawami ogólnoustrojowymi, takimi jak zmęczenie, bóle głowy, bóle mięśni i bóle stawów.
Sam rumień wędrujący nie wywołuje dolegliwości bólowych, nie ma też cech obrzęku. Jest to pierścieniowata zmiana skórna, o średnicy większej niż 5 cm, najczęściej z przejaśnieniem pośrodku. Charakterystyczną cechą rumienia wędrującego – stąd zresztą bierze się jego nazwa – jest to, że rumień się powiększa. Początkowo jest czerwoną plamką lub grudką, która rozszerza się na obwodzie. Gdy zmiana się powiększa, pojawiają się jaśniejsze obszary w jej obrębie i tworzy się obrączka rumieniowata, która oddziela rumień od zdrowej skóry.
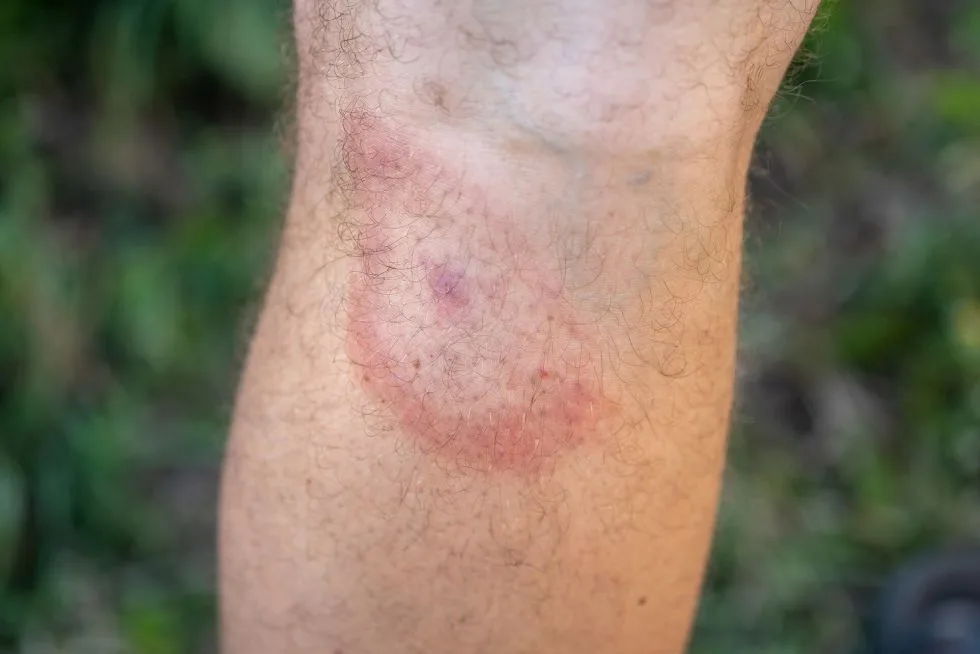
Rumień po ukąszeniu kleszcza może osiągać duże rozmiary – nawet do 80 cm. U części pacjentów zmiana jest jednolita, co utrudnia rozpoznanie. Wówczas pomocne jest określenie czy rumień się powiększa. Dlatego jeśli pacjent ma wątpliwości, warto obrysować brzegi zmiany flamastrem i ją obserwować. Warto też robić zdjęcia.
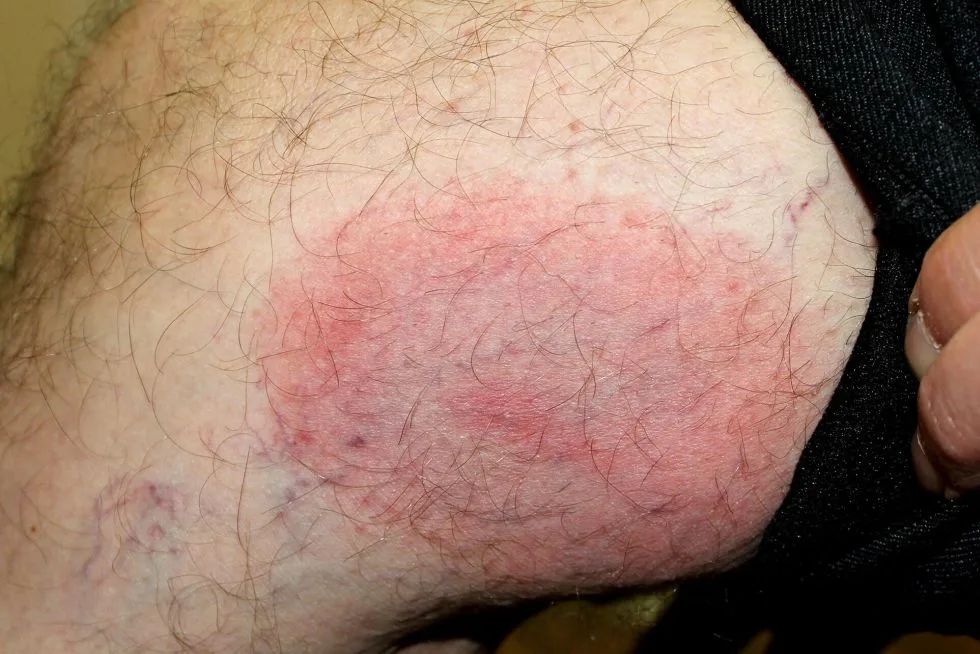
Rumień zanika samoistnie, nawet u osób nieleczonych antybiotykiem. Może to trwać nawet do 8 tygodni, średnio jednak zajmuje to ok. 4 tygodni. Zanik rumienia u pacjentów, którzy nie przyjmowali antybiotyku, nie oznacza wyleczenia z choroby.
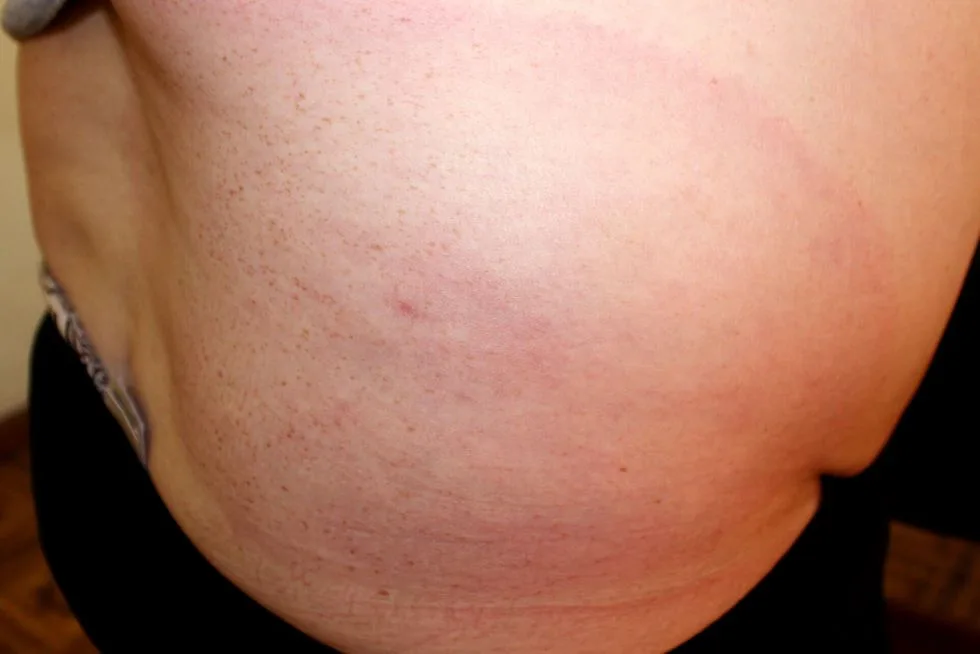
Lokalizacja rumienia zależy od tego, w którym miejscu ukłuł nas kleszcz. Często są to kończyny dolne, zwłaszcza cienka skóra pod kolanami, ale również w pachwinach i pod pachami. W praktyce kleszcz może przytwierdzić się do ciała człowieka w każdym dostępnym miejscu, również na owłosionej skórze głowy, na szyi, karku, klatce piersiowej lub brzuchu – na linii pasa. Rumienia wędrującego nie obserwuje się na skórze dłoni, podeszwach stóp i na błonach śluzowych.
Rumień wędrujący u dziecka ma taką samą postać jak u osoby dorosłej. Jego cechą charakterystyczną jest to, że powiększa swoje granice. Niektóre doniesienia wskazują, że rumień po kleszczu u dziecka może częściej występować na szyi i karku. Jednak nie powinno to zwalniać rodziców z dokładnego przejrzenia całego ciała dziecka po przyjściu ze spaceru.
Rumień wędrujący mnogi
Większość przypadków rumienia wędrującego charakteryzuje się występowaniem pojedynczej zmiany. Zdarzają się jednak sytuacje, gdy pacjent ma postać rumienia mnogiego.
Występowanie tej postaci erythema migrans jest wynikiem spirochetemii (czyli obecności krętków Borrelia we krwi), a nie pokłosiem licznych ukąszeń. U chorych z rumieniem mnogim najczęściej występują nasilone objawy ogólnoustrojowe.
Z czym łatwo pomylić rumień wędrujący?
Po ukąszeniu przez owady lub pajęczaki (do których należy kleszcz) na skórze powstaje zaczerwienienie, które jest reakcją obronną na substancje pochodzące z ich śliny. Bywa mylone z rumieniem wędrującym, dlatego warto podkreślić różnice.
Odczyn, który jest niespecyficzną reakcją na ukąszenie przez owada, powstaje bardzo szybko. Zazwyczaj jest bolesny i swędzący, a jego wielkość nie przekracza kilku centymetrów. Taki odczyn szybko ustępuje, podczas gdy rumień wędrujący utrzymuje się przez kilka tygodni.
W różnicowaniu zmiany, która utrzymuje się na skórze przez dłuższy czas, lekarz może wziąć pod uwagę:
- rumień obrączkowaty.
- zmiany grzybicze,
- kontaktowe zapalenie skóry.
Jeśli wątpliwości co do diagnozy pozostają nierozstrzygnięte, pomocne będą badania serologiczne w kierunku boreliozy, czyli oznaczenie przeciwciał przeciwko Borrelia burgdorferi w klasie IgM i IgG.

Rumień wędrujący po ukąszeniu kleszcza – jakie kroki podjąć? Leczenie rumienia wędrującego
Wystąpienie rumienia wędrującego jest jednoznaczne z rozpoznaniem choroby. Dlatego zawsze należy iść do lekarza, który zleci odpowiedni antybiotyk. W przypadku leczenia tej postaci boreliozy antybiotykiem pierwszego wyboru może być:
- doksycylina – stosowana przez 7 do 21 dni;
- amoksycylina – stosowana przez 14-21 dni;
- cefuroksym – stosowany przez 14-21 dni.
Jeśli rumień ma postać nietypową należy posiłkować się badaniami serologicznymi, w których – w zależności od czasu, jaki upłynął od ukłucia przez kleszcza – można stwierdzić obecność przeciwciał IgM oraz narastające miano przeciwciał IgG.

Rumień wędrujący – podsumowanie
Rumień wędrujący jest charakterystycznym objawem boreliozy i jednoznacznym potwierdzeniem tej choroby. Jego wystąpienie nie wymaga badań serologicznych, jest wskazaniem do antybiotykoterapii. Jeśli rumień ma postać nietypową, wskazana jest diagnostyka laboratoryjna. Niestety brak rumienia wędrującego nie wyklucza choroby. W takich przypadkach o diagnozie rozstrzygają objawy kliniczne i oznaczenie przeciwciał.
>> Więcej o pułapkach diagnostycznych i terapeutycznych w leczeniu boreliozy w artykule: Borelioza – pułapki diagnostyczne i terapeutyczne. Fakty i mity na temat rozpoznawania i leczenia
Bibliografia:
- Moniuszko-Malinowska A, Pancewicz S, Czupryna P, wsp. Zalecenia Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych dotyczące diagnostyki i leczenia boreliozy z Lyme Przegląd Epidemiologiczny – Epidemiological Review. 2023;77(3):261-278. doi:10.32394/pe.77.25.
- Czarnecki M., Borelioza – najczęstsze błędy diagnostyczne i terapeutyczne, wykład konferencja „Choroby odkleszczowe” 18.04.2024.
- http://www.pteilchz.org.pl/wp-content/uploads/2018/11/borelioza_z_lyme_2018.pdf