Bariera jelitowa odgrywa niezwykle ważną rolę w utrzymaniu równowagi całego organizmu, tzw. homeostazy. Naruszenie szczelności bariery jelitowej skutkuje przenikaniem toksyn i innych szkodliwych substancji do środowiska wewnętrznego, czyli krwi, tkanek i narządów. Może to powodować szereg konsekwencji zdrowotnych, w tym dysfunkcje przewodu pokarmowego, infekcje ogólnoustrojowe, nadwrażliwości pokarmowe i choroby autoimmunologiczne. Stosunkowo niedawno wykazano, że na regulację połączeń w nabłonku jelitowym i przepuszczalność bariery jelitowej wpływa zonulina. Z tego artykułu dowiesz się, czym jest to białko, jakie pełni funkcje oraz jak zbadać jego poziom w organizmie.
Spis treści:
- Czym jest zonulina?
- Zonulina – właściwości i znaczenie dla jelit
- Prawidłowa funkcja barierowa jelit a ich przepuszczalność
- Zonulina a przepuszczalność jelit – jej rola
- Zonulina i choroby związane z przepuszczalnością jelitową
- Diagnozowanie i monitorowanie poziomu zonuliny
- Zonulina i przepuszczalność jelit – podsumowanie
Czym jest zonulina?
Zonulina została odkryta w 2000 r. Badacze opisali ją jako białko ścisłych połączeń (ang. tight junctions, TJ) pomiędzy enterocytami (enerocytami) – komórkami nabłonka jelita cienkiego. Wydzielana jest zarówno przez nabłonek jelita, jak i wątrobę. Rolą zonuliny jest regulacja przepuszczalności bariery jelitowej. Pomimo że większość informacji dotyczących tego białka koncentruje się na jego działaniu w jelitach, istnieją także dowody na znaczenie zonuliny w innych narządach, takich jak mózg, serce, płuca, nerki, wątroba oraz skóra.
Zonulina – właściwości i znaczenie dla jelit
Zonulina jest uznawana za marker integralności ścisłych połączeń pomiędzy enterocytami. Otwierając i zamykając połączenia ścisłe w jelitach, wpływa na transport płynów, substancji odżywczych, jonów i innych cząsteczek rozpuszczalnych w wodzie oraz komórek układu immunologicznego między światłem jelita a krwiobiegiem. Oddziałuje zatem zarówno na przepuszczalność śluzówki jelit, jak i na odpowiedź immunologiczną. Zonulina jest również prekursorem haptoglobiny (białka ostrej fazy zapalenia), wydzielanej przez organizm w odpowiedzi na stan zapalny lub infekcje. Istnieją też dowody na to, że zonulina pełni funkcję ochronną przed kolonizacją drobnoustrojów w końcowym odcinku jelita.
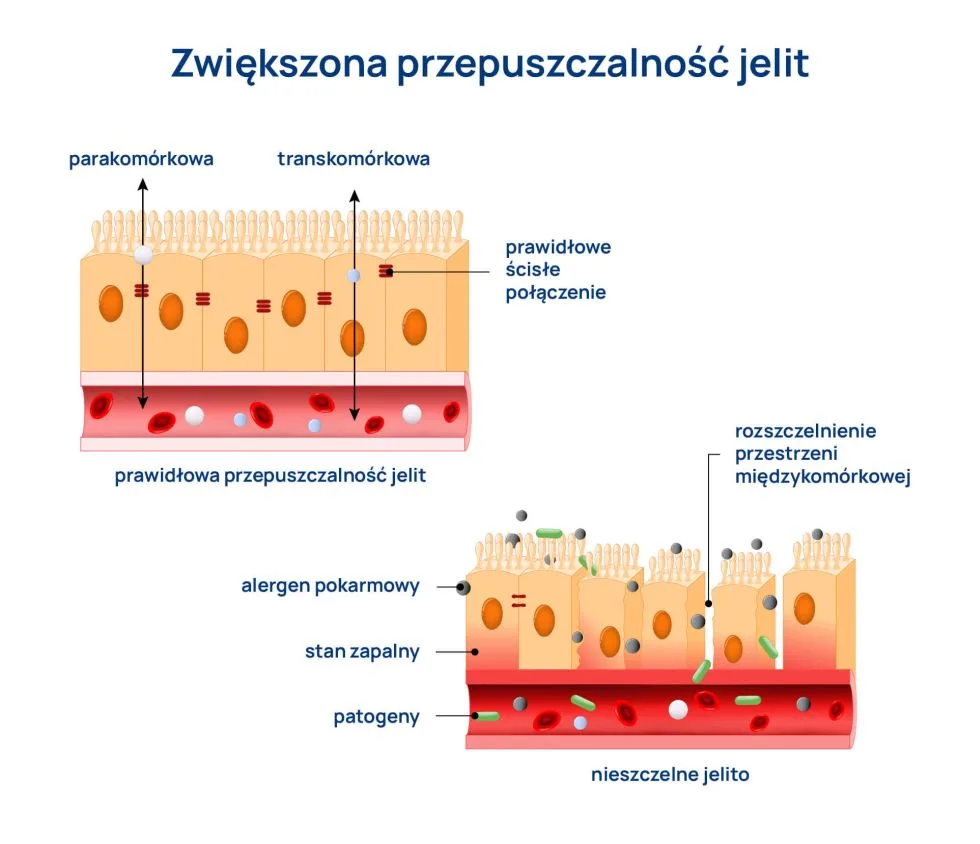
Prawidłowa funkcja barierowa jelit a ich przepuszczalność
W skład bariery jelitowej wchodzą komórki układu krwionośnego, nerwowego i immunologicznego oraz komórki nabłonkowe, pokryte warstwą śluzu zasiedlanego przez mikroorganizmy tworzące tzw. mikrobiotę jelitową. Ta ostatnia jest szczególnie istotna, ponieważ udowodniono, że zmniejszenie warstwy śluzu prowadzi do zwiększenia przepuszczalności jelita, umożliwiając przedostawanie się do wnętrza organizmu drobnoustrojów. Białka ścisłych połączeń, takie jak zonulina, łączą komórki nabłonka jelit, regulując ich przepuszczalność. Naruszenie tej bariery powoduje zwiększoną przepuszczalność jelit, co z kolei ułatwia transport szkodliwych substancji i drobnoustrojów do krwiobiegu i może powodować wiele chorób. Jelito jest zatem łącznikiem pomiędzy środowiskiem zewnętrznym a wewnętrznym ustroju, dlatego niezwykle ważną rolę w utrzymaniu równowagi zarówno jelita, jak i całego organizmu pełni prawidłowo funkcjonująca bariera jelitowa.
Zonulina a przepuszczalność jelit – jej rola
Zonulina, będąc modulatorem ścisłych połączeń międzykomórkowych, jest uważana za marker zwiększonej przepuszczalności jelitowej (ang. intestinal permeability, IP). Podwyższony poziom tego białka może prowadzić do zaburzenia funkcjonowania i rozszczelnienia bariery jelitowej, czyli tzw. zespołu przesiąkliwego jelita (ang. leaky gut syndrome). Skutkuje to przenikaniem do krwi dużych cząstek pokarmowych, toksyn, patogenów i innych substancji, zdolnych do aktywowania odpowiedzi immunologicznej, co wywołuje stan zapalny i sygnalizuje zachodzenie nieprawidłowych procesów w jelicie.
Zonulina i choroby związane z przepuszczalnością jelitową
Zaburzenia funkcjonowania bariery jelitowej, prowadzące do zespołu przesiąkliwego jelita, zostały powiązane z patogenezą kilku stanów chorobowych, w tym chorób autoimmunologicznych i zapalnych. Stwierdzono, że niektóre czynniki środowiskowe, takie jak bakterie i gluten, mogą stymulować uwalnianie zonuliny w jelitach. Zwiększona przepuszczalność jelit wydaje się kluczowym czynnikiem w patogenezie:
- celiakii,
- cukrzycy typu I,
- choroby Leśniowskiego-Crohna,
- zespołu jelita drażliwego,
- wrzodziejącego zapalenia jelita grubego,
- alergii,
- astmy,
- reumatoidalnego zapalenia stawów.
U osób z tymi schorzeniami badania wykazały wyższy poziom zonuliny niż u ludzi zdrowych. Zonulina może być zatem wykorzystywana jako marker upośledzonej funkcji bariery jelitowej, może także stanowić potencjalny cel terapeutyczny w leczeniu tych chorób.
Diagnozowanie i monitorowanie poziomu zonuliny
Aby móc ocenić funkcjonowanie bariery jelitowej przy podejrzeniu stanu zapalnego jelita lub dolegliwościach ze strony układu pokarmowego, zaleca się przeprowadzenie badania poziomu zonuliny.
Badanie zonuliny z kału – kiedy wykonać
Badanie poziomu zonuliny może być wykonane z próbki kału, ale wybór materiału do badania zależy od konkretnej sytuacji klinicznej i celu diagnostycznego. Kał należy pobrać ze sterylnego naczynia do jednorazowego pojemnika. Można zrobić to o dowolnej porze dnia, nie trzeba być na czczo ani modyfikować diety. Oznaczenie w teście jest ilościowe, wykonywane metodą immunoenzymatyczną ELISA (ang. enzyme-linked immunosorbent assay).
Badanie zonuliny z kału jest wskazane przede wszystkim przy podejrzeniu chorób przewodu pokarmowego, takich jak zespół jelita drażliwego, choroba Leśniowskiego-Crohna czy wrzodziejące zapalenie jelita grubego, ponieważ odzwierciedla bezpośrednią aktywność i stan bariery jelitowej.

Podwyższony poziom (stężenie) zonuliny – leczenie
Leczenie zbyt wysokiego poziomu zonuliny wymaga podejścia wieloaspektowego, które może obejmować:
- zmiany w diecie, np. wprowadzenie diety bezglutenowej, unikanie przetworzonej żywności;
- suplementację, np. wprowadzenie probiotyków i prebiotyków, L-glutaminy, cynku, kwasów omega-3, które wspierają zdrowie jelit;
- modyfikację stylu życia, np. redukcję stresu i regularną aktywność fizyczną;
- leczenie farmakologiczne, np. leki przeciwzapalne i antybiotyki.
Wybrana metoda zależy od przyczyny podwyższonego poziomu zonuliny. Ważne jest skonsultowanie się z lekarzem, aby opracować odpowiedni plan leczenia.
Zonulina i przepuszczalność jelit – podsumowanie
Ścisłe połączenia między enterocytami, składające się z takich białek jak zonulina, odgrywają ważną rolę w kontrolowaniu przepuszczalności ściany jelitowej, która warunkuje prawidłowe funkcjonowanie jelita. W wielu badaniach naukowych wykazano rolę zonuliny w utrzymaniu szczelności bariery jelitowej i korelację podwyższonego poziomu tego białka z patomechanizmem wielu chorób. Badanie poziomu zonuliny w organizmie pozwala więc na ocenę przepuszczalności bariery jelitowej, a podwyższone stężenie tego białka świadczy o jej rozszczelnieniu i jest sygnałem do wykonania dalszych badań w celu zidentyfikowania źródła problemu.
Bibliografia
- Serek P. i in., The Effect of Bacterial Infections, Probiotics and Zonulin on Intestinal Barrier Integrity, Int. J. Mol. Sci. 2021; 22, 11359. https://doi.org/10.3390/ijms222111359
- Fasano A. i in., All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res. 2020; 9: F1000 Faculty Rev-69. doi: 10.12688/f1000research.20510.1.
- König J. i in., Human Intestinal Barrier Function in Health and Disease. Clin Transl Gastroenterol 2016; 7(10): s. e196, doi: 10.1038/ctg.2016.54
- https://cambridge-diagnostics.pl/zonulina-badania-jelita-pokarmowego-w-cambridge-diagnostics/ [dostęp: 20.06.2024]