Lepiej zapobiegać niż leczyć – zdecydowanie tak! Z dowodów naukowych i obserwacji widzimy, że otyłość pogarsza jakość życia osób na nią cierpiących. Jej przyczyny mogą być nie tylko genetyczne i hormonalne, ale również środowiskowe. Wielu pacjentów, zwłaszcza obciążonych dodatnim wywiadem rodzinnym w kierunku otyłości, szuka odpowiedzi na następujące pytanie: jakie są elementy skuteczniej profilaktyki? Odpowiedź znajduje się w poniższym artykule.
Spis treści:
- Czym jest otyłość?
- Przyczyny otyłości
- Skutki otyłości
- Otyłość – jak ją rozpoznać?
- Jak wygląda leczenie otyłości?
- Profilaktyka otyłości
- W jaki sposób można zapobiec otyłości?
Czym jest otyłość?
Otyłość z definicji to choroba charakteryzująca się patologicznym nagromadzeniem tkanki tłuszczowej bez tendencji do samoistnego ustępowania. Z tego powodu może dochodzić do uszkodzenia poszczególnych narządów lub układów, a to z kolei prowadzi do pogorszenia jakości życia, niepełnosprawności oraz zwiększonego ryzyka przedwczesnego zgonu. Jest klasyfikowana w Międzynarodowej Klasyfikacji Chorób (ICD-10) pod numerem E66.
Przyczyny otyłości
U ponad 90% osób otyłych stwierdza się otyłość prostą, która wynika z dodatniego bilansu energetycznego, niskiej aktywności fizycznej i/lub zaburzeń psychiczno-emocjonalnych. U pozostałych osób przyczyny otyłości są wtórne. Przyczynami otyłości wtórnej mogą być zespoły genetyczne, zaburzenia endokrynologiczne, choroby podwzgórza lub farmakoterapia (otyłość polekowa). Wśród przyczyn otyłości wymienia się również czynniki środowiskowe oraz psychologiczne (zaburzenia odżywiania).
Uwarunkowane genetycznie zespoły wad wrodzonych:
- Zespół Bardeta-Biedla,
- Zespół Pradera-Williego,
- Zespół Turnera,
- Zespół Morgagniego-Stewarta-Morela,
- Zespół wielotorbielowatych jajników (zespół Steina-Leventhala),
- Choroba Dercuma,
- Choroba von Gierkego.
Wyróżnia się również otyłość uwarunkowaną monogenowo – stanowi ona niecałe 5% wszystkich przypadków i jest spowodowana mutacją genu receptora leptyny.
Endokrynologiczne przyczyny otyłości:
- Rzekoma niedoczynność przysadki,
- Nowotwór neuroendokrynny (insulinoma).
>> Dowiedz się: Brzuch tarczycowy – jak rozpoznać i zwalczyć otyłość brzuszną o podłożu hormonalnym
Czynniki środowiskowe, które mają największy wpływ na występowanie otyłości, to:
- status społeczno-ekonomiczny (poziom wykształcenia, wykonywany zawód, dochód);
- rodzinne wzorce żywieniowe;
- mała aktywność ruchowa spowodowana motoryzacją, mechanizacją i wzrostem urbanizacji;
- pośpiech cywilizacyjny, dłuższy czas pracy (mniej czasu na przygotowywanie i wspólne celebrowanie posiłków);
- przewlekły stres (kompensowanie negatywnych emocji jedzeniem);
- silny wpływ marketingu na wybory żywieniowe konsumentów (siła reklamy i mediów, porcje XXL, liczne promocje);
- łatwe gromadzenie i przechowywanie żywności (lodówki, zamrażarki);
- wpływ mediów społecznościowych – lęk przed nadmierną masa ciała, presja posiadania wysportowanego ciała (obniżenie samooceny, brak akceptacji niedoskonałości własnego ciała), większa koncentracja na tym co zewnętrzne (outfit, makijaż, włosy, paznokcie).
>> Odkryj, jaki jest: Wpływ otyłości, zapalenia i leptyny na choroby cywilizacyjne
Czynniki psychologiczne otyłości – zaburzenia jedzenia (według ICD-11):
- zaburzenie z napadami objadania się (Binge-Eating Disorder, BED);
- żarłoczność psychiczna, bulimia (Bulimia Nervosa, BN);
- zespół jedzenia nocnego (Night Eating Syndrome, NES).

Skutki otyłości
Otyłość przyczynia się do występowania wielu zaburzeń, chorób i problemów, takich jak:
- zaburzenia metaboliczne: zaburzenia lipidowe, cukrzyca typu 2, zespół metaboliczny, insulinooporność;
- zaburzenia płodności;
- choroby przewodu pokarmowego: kamica pęcherzyka żółciowego, refluks żołądkowo-przełykowy, niealkoholowa stłuszczenia choroba wątroby (NAFLD);
- choroba zwyrodnieniowa stawów i bóle stawów;
- choroby układu krążenia: nadciśnienie tętnicze, miażdżyca, niewydolność krążenia, udar mózgu, choroba niedokrwienna serca;
- choroby układu oddechowego: niedotlenienie, zespół bezdechu sennego;
- problemy psychiczne i społeczne: niska samoocena, izolacja społeczna;
- problemy ekonomiczne: problemy z zatrudnieniem, wczesna renta, obciążenie systemów publicznej opieki zdrowotnej.

Otyłość – jak ją rozpoznać?
W powszechnej praktyce otyłość w badaniach przesiewowych rozpoznaje się na podstawie wskaźnika masy ciała (body mass index – BMI). Wskaźnika BMI nie stosuje się u osób, które dużo trenują i mają większą zawartość tkanki mięśniowej (wyniki fałszywie dodatnie). Otyłość rozpoznaje się przy BMI ≥30 kg/㎡.
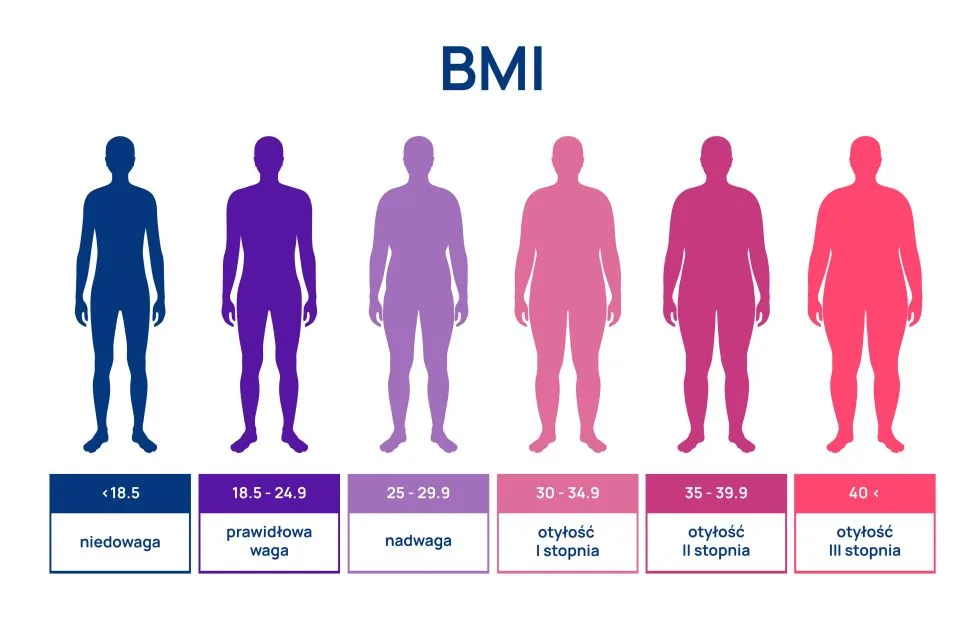
Otyłość brzuszną (inaczej nazywaną wisceralną, typu jabłko lub androidalną) rozpoznaje się, kiedy obwód tali wynosi powyżej 88 cm u kobiet oraz 102 cm u mężczyzn. Otyłość brzuszną rozpoznaje się również na podstawie wskaźnika WHR (Waist-to-Hip Ratio). Występuje ona w przypadku, kiedy wskaźnik WHR ≥ 0,8 dla kobiet oraz ≥ 1 u mężczyzn. W świetle badań naukowych otyłość brzuszna znacznie zwiększa ryzyko rozwoju powikłań otyłości.
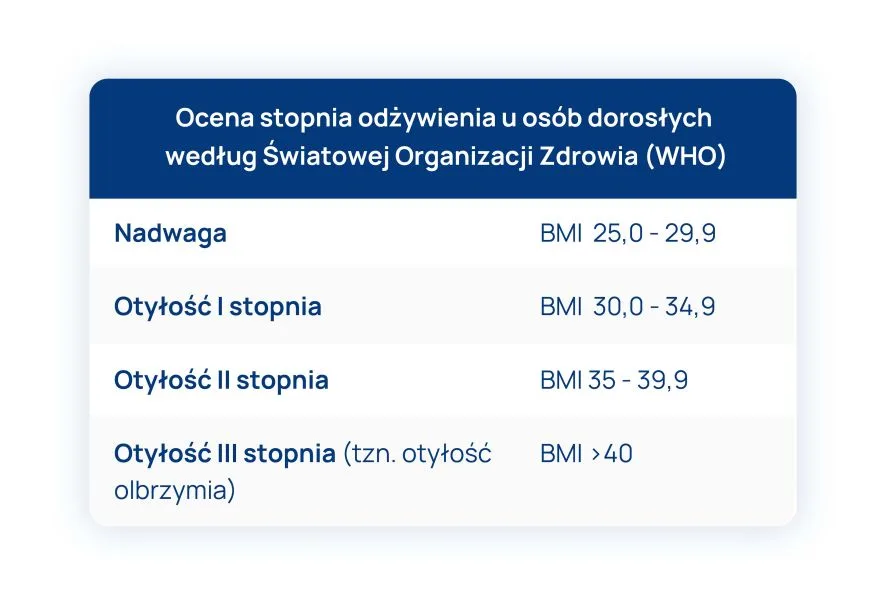
Tabela 1.: Ocena stopnia odżywienia u osób dorosłych według Światowej Organizacji Zdrowia (WHO).
Wiarygodniejszą metodą na rozpoznanie otyłości jest metoda bioelektroimpedencji, która umożliwia analizę składu ciała. Metoda ta jest wiarygodniejszą, ponieważ otyłość związana jest z nadmierną tkanką tłuszczową, a nie nadmierną masą ciała. Otyłość rozpoznaje się wówczas na podstawie zawartości tkanki tłuszczowej w organizmie. Jeżeli zawartość tłuszczu w ciele u mężczyzn przekracza 25%, a u kobiet 30%.
Do rozpoznania otyłości u dzieci stosuje się natomiast siatki centylowe BMI, które znaleźć można w książeczce zdrowia dziecka. Znacznik powyżej 99. centyla wskazuje na otyłość dziecka.
>> Więcej informacji na ten temat: Otyłość u dzieci i młodzieży – poważna choroba i duże wyzwanie
Jak wygląda leczenie otyłości?
Leczenie otyłości zależy od BMI i występowania chorób współistniejących. Ze względu na skłonność do nawrotów jej leczenie jest procesem długotrwałym. Ma na celu nie tylko redukcję masy ciała, ale przede wszystkim zmniejszenie czynników ryzyka oraz poprawę stanu zdrowia pacjenta (wyników badań). Rzadko dąży się do uzyskania należnej masy ciała. Udowodniono, że miarkowany ubytek masy ciała przynosi pozytywne efekty metaboliczne, takie jak poprawa profilu lipidowego, obniżenie stężenia glukozy i insuliny oraz obniżenie ciśnienia, a także znacznie poprawia jakość życia pacjentów. Jest to 5-15% wyjściowej masy ciała w przypadku otyłości I stopnia oraz 5-10% w przypadku otyłości II i III stopnia.
Leczenie powinno być zindywidualizowane i uwzględniać ogólny stan zdrowia pacjenta.
- W przypadku pacjentów z nadwagą, których BMI wynosi 25-29,9 kg/㎡, ale nie występują choroby współistniejące postępowanie medyczne sprowadza się do edukacji żywieniowej i zwiększenia aktywności fizycznej.
- W przypadku pacjentów z nadwagą z BMI >27 kg/㎡, u których występują choroby współistniejące (np. zaburzenia gospodarki węglowodanowej, lipidowej, nadciśnienie, dodatni wywiad rodzinny w kierunku cukrzycy typu 2) dąży się do redukcji masy ciała poprzez indywidualnie ułożoną dietę, zaplanowaną aktywności fizyczną, farmakoterapię oraz terapie behawioralną.
- Do zabiegu bariatrycznego kwalifikują się dwie grupy pacjentów. Pierwszą grupą są osoby chorujące na otyłość olbrzymią (BMI≥40 kg/㎡). Drugą grupą to osoby z otyłością II stopnia (BMI > 30 kg/㎡) oraz chorobami współistniejącymi.

Profilaktyka otyłości
Profilaktyka otyłości to nic innego jak promocja zdrowia. W ramach jej działań rozróżnia się profilaktykę pierwotną (pierwszorzędową), wtórną (drugorzędową), oraz trzeciorzędową (III fazy).
Profilaktyka pierwotna dotyczy osób zdrowych. Są to działania najwcześniejsze – ich celem jest niedopuszczenie do pojawienia się choroby.
Działania w ramach profilaktyki pierwotnej obejmują:
- promocję zdrowego stylu życia i zachowań sprzyjających zdrowiu – dotyczących odżywiania, aktywności fizycznej, sposobu spędzania wolnego czasu oraz higieny życia (sen, odpoczynek, higiena spożywania posiłków);
- promocję zdrowia psychicznego (m.in. unikanie jedzenia emocjonalnego, „ucieczki w jedzenie”);
- promocję karmienia piersią – badania naukowe wykazują ochronną rolę karmienia piersią w odniesieniu do otyłości;
Profilaktyka wtórna dotyczy osób ze zwiększonym ryzykiem wystąpienia choroby i obejmuje m.in.:
- testy przesiewowe w kierunku otyłości (powszechnie stosowanym narzędziem do oceny prawidłowości masy ciała jest wyżej opisany wskaźnik BMI);
- profilaktyczne badania lekarskie (tzw. bilans zdrowia dzieci) wykonywane przez lekarza podstawowej opieki zdrowotnej.
>> Przeczytaj: Żywienie w otyłości dzieci i młodzieży
Profilaktyka trzeciorzędowa (III fazy) obejmuje poradnictwo, opiekę medyczną, psychologiczną oraz rehabilitację osób z problemami zdrowotnymi, chorobami przewlekłymi i niepełnosprawnością. Jej celem jest zminimalizowanie lub zapobieganie dalszym skutkom zaburzeń, a także zapewnienie wsparcia w:
- radzeniu sobie z chorobą i zaakceptowaniu swojego stanu;
- utrzymaniu dobrego samopoczucia i kondycji fizycznej;
- utrzymaniu relacji i przeciwdziałanie izolacji społecznej.
A co z aktywnością ruchową? Światowa Organizacja Zdrowia (WHO) rekomenduje, aby osoby dorosłe wykonywały aktywność fizyczną przez 150-300 minut w tygodniu o umiarkowanej intensywności lub 75-150 minut o dużej intensywności. Dodatkowo, zaleca się co najmniej 2 razy w tygodniu ćwiczenia wzmacniające mięśnie. Natomiast dzieci powyżej 5. roku życia powinny podejmować się godzinnej aktywności fizycznej każdego dnia – włączając w to ćwiczenia wzmacniające mięśnie i kości 3 razy w tygodniu. W wytycznych podkreśla się, że nawet jeśli nie spełnia się powyższych zaleceń, „podejmowanie jakiejkolwiek aktywności fizycznej jest lepsze, niż jej brak”. Należy zaznaczyć, że owe wytyczne dotyczą osób zdrowych, chcących zachować zdrowie. Aktywność fizyczna w leczeniu otyłości wygląda inaczej.

W jaki sposób można zapobiec otyłości?
Profilaktyka otyłości jest bardzo ważna – zwłaszcza jeśli chodzi o osoby z dodatnim wywiadem rodzinnym. Największy wpływ na zdrowie ma styl życia (według koncepcji „pól Lalonde’a” jest determinantem zdrowia stanowiącym nawet 53%). Na to składa się aktywność fizyczna, sposób odżywiania się, umiejętności radzenia sobie ze stresem, niestosowanie używek (nikotyna, alkohol, środki psychoaktywne) oraz higiena życia. Warto korzystać z wszelkich prozdrowotnych programów oraz starać się wdrażać codziennie profilaktykę przeciwko otyłości.
Źródła:
- Zalecenia kliniczne dotyczące postępowania u chorych na otyłość 2022: ws_otylosc.pdf (ptlo.org.pl)
- ncez.pzh.gov.pl/wp-content/uploads/2022/12/Nadwaga-i-otylosc.-Malymi-Krokami-do-Zdrowia..pdf
- Rozpoznawanie i leczenie otyłości. Omówienie zasad postępowania zgodnie z aktualnymi wytycznymi – Nadwaga i otyłość – Medycyna Praktyczna dla lekarzy (mp.pl)
- Lange E.: Dietoterapia i profilaktyka otyłości. W: Głąbska D., Kozłowska L., Lange E., Włodarek D., Dietoterapia. Wydawnictwo Lekarskie PZWL, Warszawa 2014.
- Obesity: preventing and managing the global epidemic: report of a WHO consultation WHO_TRS_894.pdf
- Instytut profilaktyki Zdrowia: Uwarunkowania zdrowia | ipz.org.pl
- PL_At_a_Glance_WHO_Guidelines_on_physical_activity_PL_2020_04_29_v2.pdf (kif.info.pl)
- Narodowy Program Zdrowia na lata 2021 – 2025 – Ministerstwo Spraw Wewnętrznych i Administracji – Portal Gov.pl (www.gov.pl)
- LPOZ_Art_42579-10.pdf