Tężyczka utajona to najczęstsza postać tężyczki, występująca przede wszystkim u młodych pacjentów. Jakie są przyczyny tężyczki utajonej i jakie czynniki prowadzą do pojawienia się objawów? Na czym polega leczenie tężyczki utajonej? Czy tężyczka utajona jest związana tylko z czynnikami emocjonalnymi? Odpowiedzi na te pytania znajdziemy w poniższym artykule.
Spis treści:
- Tężyczka utajona – co to za choroba?
- Tężyczka utajona – przyczyny
- Jakie są objawy tężyczki utajonej?
- Jak wygląda atak tężyczki utajonej?
- Tężyczka utajona – jakie badania wykonać?
- Tężyczka utajona – na czym polega leczenie?
Tężyczka utajona – co to za choroba?
Tężyczka to zespół objawów cechujący się nadmierną pobudliwością nerwowo-mięśniową. Tężyczkę klinicznie dzieli się na dwie odmiany – tężyczkę objawową oraz tężyczkę utajoną, nazywaną również spazmofilią.
Klasyczna tężyczka objawowa manifestuje się symetrycznymi skurczami mięśni, co wynika przede wszystkim z zaburzeń elektrolitowych pod postacią obniżenia stężenia wapnia, a czasami również magnezu i potasu. Symptomy tężyczki utajonej są mniej charakterystyczne, co sprawia, że ta odmiana choroby jest trudniejsza do zdiagnozowania.
Tężyczka utajona występuje w populacji znacznie częściej niż odmiana pełnoobjawowa. Dane literaturowe donoszą, że tężyczka utajona stanowi nawet 60-70% wszystkich przypadków tej choroby. Spazmofilia częściej dotyka osób młodych, szczególnie płci żeńskiej.
Tężyczka utajona – przyczyny
Do ujawnienia się tężyczki utajonej konieczne jest zadziałanie pewnego czynnika wyzwalającego. Najczęściej jest to hiperwentylacja, a więc głębokie i częste oddechy, związane zazwyczaj z napięciem emocjonalnym i silnym stresem.
>> Przeczytaj: Stres – przyjaciel czy wróg? Jak można to zbadać?
Hiperwentylacja wyzwala tężyczkę poprzez podwyższenie odczynu krwi (pH), a więc przesunięcia go w kierunku bardziej zasadowego (zasadowica oddechowa). Prowadzi to do wiązania się wapnia z albuminami (należącymi do białek), a tym samym do obniżenia się stężenia wapnia zjonizowanego w surowicy krwi. Należy mieć jednak świadomość, że zasadowica oddechowa może prowokować tężyczkę również przy prawidłowym stężeniu wapnia zjonizowanego.

Ponadto, do przyczyn tężyczki utajonej należy również obniżone stężenie magnezu, a więc hipomagnezemia. To zaburzenie elektrolitowe może wynikać między innymi z:
- defektów genetycznych (na przykład z mutacji w obrębie genu TRPM6, który jest zlokalizowany na chromosomie 9),
- zbyt małego spożycia magnezu wraz z pokarmem,
- zaburzeń wchłaniania magnezu w przewodzie pokarmowym,
- przewlekłych biegunek (nadmierne wydalanie magnezu przez przewód pokarmowy),
- przyjmowania leków, zwiększających wydalanie magnezu wraz z moczem,
- zaburzeń czynności nerek.

Jakie są objawy tężyczki utajonej?
Dla tężyczki utajonej charakterystyczne jest to, że przebiega w sposób skryty, a do ujawnienia się objawów chorobowych konieczne jest zadziałanie pewnego czynnika wyzwalającego. Jednym z najważniejszych czynników wyzwalających objawy tężyczki utajonej jest wspomniana już hiperwentylacja. Warto mieć świadomość, że hiperwentylacja może wiązać się nie tylko z czynnikami emocjonalnymi, ale również być związana z zaostrzeniem astmy oskrzelowej, zatorowością płucną, zawałem mięśnia sercowego, jak również z niedokrwistością, związaną z nagłą utratą krwi.
Objawy tężyczki utajonej nie są zbyt charakterystyczne, co sprawia, że diagnostyka tego schorzenia nie jest łatwa. Najczęstsze symptomy tężyczki utajonej to:
- wzmożone napięcie mięśniowe,
- zwiększona męczliwość,
- przewlekłe zmęczenie,
- zmiany nastroju,
- zaburzenia snu,
- dolegliwości bóle w obrębie klatki piersiowej i jamy brzusznej,
- uczucie kołatania serca,
- wzdęcia, biegunki, czasami zaparcia.
>> Dowiedz się więcej: Wzdęcia brzucha – czym są, jakie mogą być przyczyny, kiedy zgłosić się do lekarza?
Jak wygląda atak tężyczki utajonej?
Objawy tężyczki utajonej nie występują w formie napadowej, tak jak ma to miejsce w przypadku klasycznej odmiany tej choroby. Warto wspomnieć, że w medycynie wyróżniamy pewne charakterystyczne objawy związane z tężyczką utajoną, które można wywołać. Mowa tutaj o:
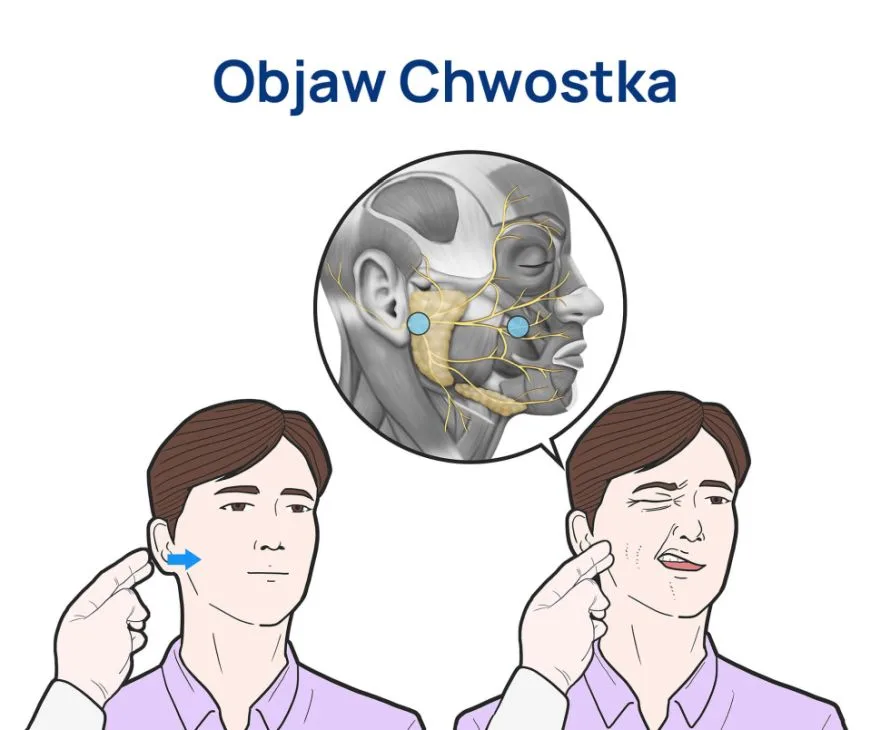
- objawie Chwostka – po uderzeniu młotkiem neurologicznym w policzek na przebiegu nerwu twarzowego, dochodzi do wyzwolenia skurczów w obrębie mięśni twarzy, zazwyczaj jednostronnie, w cięższych przypadkach również obustronnie,
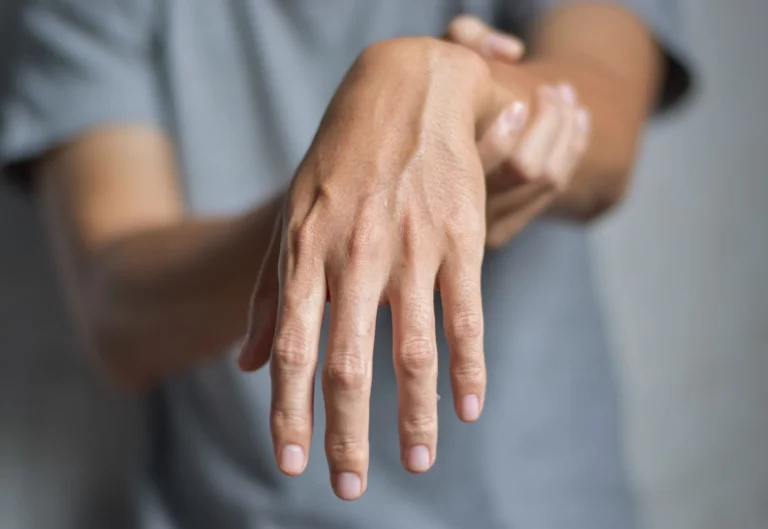
- objawie Trousseau – w tym przypadku mamy do czynienia ze skurczami w obrębie dłoni i ułożeniem ręki w tak zwaną rękę położnika. Objaw ten jest wyzwalany poprzez uciśnięcie ramienia mankietem aparatu do pomiaru ciśnienia tętniczego, co wywołuje niedotlenienie,
- objawie Erba – polega on na wygenerowaniu podwyższonej pobudliwość nerwów ruchowych w odpowiedzi na prąd galwaniczny,
- objawie Lusta – po uderzeniu młoteczkiem neurologicznym w nerw strzałkowy wspólny (uderza się w miejsce poniżej głowy kości strzałkowej w obrębie podudzia) dochodzi do wygenerowania skurczu mięśni strzałkowych, co powoduje odwiedzenie stopy oraz wygórowane odruchy ścięgniste.
Tężyczka utajona – jakie badania wykonać?
Pierwszym krokiem diagnostycznym jest przeprowadzenie dokładnego wywiadu chorobowego oraz przeprowadzenie badania neurologicznego, w tym prób wywołania objawów opisanych w poprzednim akapicie tego artykułu.
Złotym standardem jest wykonanie próby tężyczkowej, a więc badania elektromiograficznego. Polega ono na wywołaniu wieloiglicowych potencjałów wyładowań w obrębie mięśni po prowokacji niedokrwieniem lub hiperwentylacją (do wykonania badania niezbędne jest prowadzenie specjalnej elektrody do mięśnia międzykostnego).
Oprócz badania elektromiograficznego konieczne jest również wykonanie badań laboratoryjnych, w tym oznaczenia stężenia:
- wapnia, magnezu, potasu, fosforu,
- fosfatazy zasadowej,
- kreatyniny – jej stężenie pozwala na wstępną ocenę funkcjonowania nerek,
- parathormonu – hormonu regulującego gospodarkę wapniowo-fosforanową.
>> Dowiedz się, jak wygląda: Diagnostyka zaburzeń wapniowych
W trakcie diagnozowania tężyczki ważne jest również wykonanie badania EKG, ponieważ schorzenie to może wiązać się z zaburzeniami rytmu serca. W niektórych sytuacjach lekarz może zdecydować się na wykonanie badania EEG, czyli badania, które pozwala na ocenę bioelektrycznej czynności mózgu.

Tężyczka utajona – na czym polega leczenie?
Leczenie tężyczki utajonej polega przede wszystkim na uzupełnieniu niedoborów mineralnych, a więc na podawaniu magnezu. Do magnezu warto dołączyć witaminę B6, która ułatwia przyswajanie tego pierwiastka.

Warto wspomnieć, że przeciwwskazaniami do podawania magnezu jest miastenia, niektóre zaburzenia rytmu serca, a także ciężka niewydolność nerek. Jeżeli tężyczka utajona związana jest z hiperwentylacją występującą w związku z czynnikami emocjonalnymi, to konieczna jest również opieka psychologiczna.
Ze względu na niespecyficzne objawy tężyczka utajona często sprawia problemy diagnostyczne. Jeżeli istnieje podejrzenia występowania tego zespołu chorobowego, to konieczne jest przeprowadzenie badania elektromiograficznego oraz niezbędnych badań laboratoryjnych. Leczenie tężyczki utajonej powinno być kompleksowe i obejmować również wsparcie psychologiczne.
Bibliografia:
- R. Murray i inni, Biochemia Harpera, Wydawnictwo Lekarskie PZWL, Wydanie V, Warszawa 2006,
- P. Gajewski, Interna Szczeklika. Podręcznik chorób wewnętrznych, Medycyna Praktyczna, Kraków 2019/2020,
- A. Szutowicz i inni, Diagnostyka laboratoryjna, Gdański Uniwersytet Medyczny, Gdańsk 2009,
- A. Jopek i inni, Tężyczka u dzieci – diagnostyka i leczenie, Neurologia dziecięca, Vol. 28/2019, nr 57.