Metaliczny posmak w ustach to specyficzne doznanie, które może mieć różnorodne przyczyny. W wielu przypadkach to całkowicie niegroźny i przejściowy objaw. Jednak zdarza się, że jest zwiastunem poważniejszych problemów zdrowotnych. Dowiedz się, o czym świadczy metaliczny posmak w ustach i jak można sobie z nim poradzić.
Spis treści:
- Co oznacza metaliczny posmak w ustach?
- Metaliczny posmak w ustach: przyczyny
- Metaliczny posmak w ustach w ciąży
- Posmak metalu w ustach: o jakiej chorobie może świadczyć?
- Jak pozbyć się metalicznego smaku w ustach?
- Kiedy posmak metalu w ustach powinien być powodem do niepokoju?
Co oznacza metaliczny posmak w ustach?
Metaliczny posmak w ustach jest specyficznym wrażeniem smakowym, często uznawanym za nieprzyjemny. Zwykle opisywany jest jako smak żelaza lub miedzi. W zależności od przyczyny pojawia się sporadycznie i mija samoistnie lub utrzymuje się przez dłuższy czas. W drugim przypadku posmak metalu w ustach nigdy nie powinien być bagatelizowany, ponieważ może wskazywać na problemy zdrowotne wymagające interwencji lekarskiej.

Metaliczny posmak w ustach: przyczyny
Przyczyny metalicznego posmaku w buzi mogą być różne. Jest to objaw niezwiązany z żadną konkretną jednostką chorobową. W wielu przypadkach nie świadczy o żadnych problemach zdrowotnych, a jest wynikiem m.in. nieprawidłowej higieny jamy ustnej, palenia papierosów czy skutkiem ubocznym przyjmowania niektórych leków (np. chemioterapeutyków, antybiotyków, preparatów żelaza lub cynku).
Inne możliwe przyczyny posmaku metalu w ustach to:
- infekcje wirusowe lub grzybicze,
- zaburzenia w odczuwaniu bodźców smakowych (halucynacje smakowe mimo braku bodźca smakowego),
- zespół pieczenia jamy ustnej (schorzenie dotyczące osób w średnim i starszym wieku),
- odwodnienie,
- ciąża,
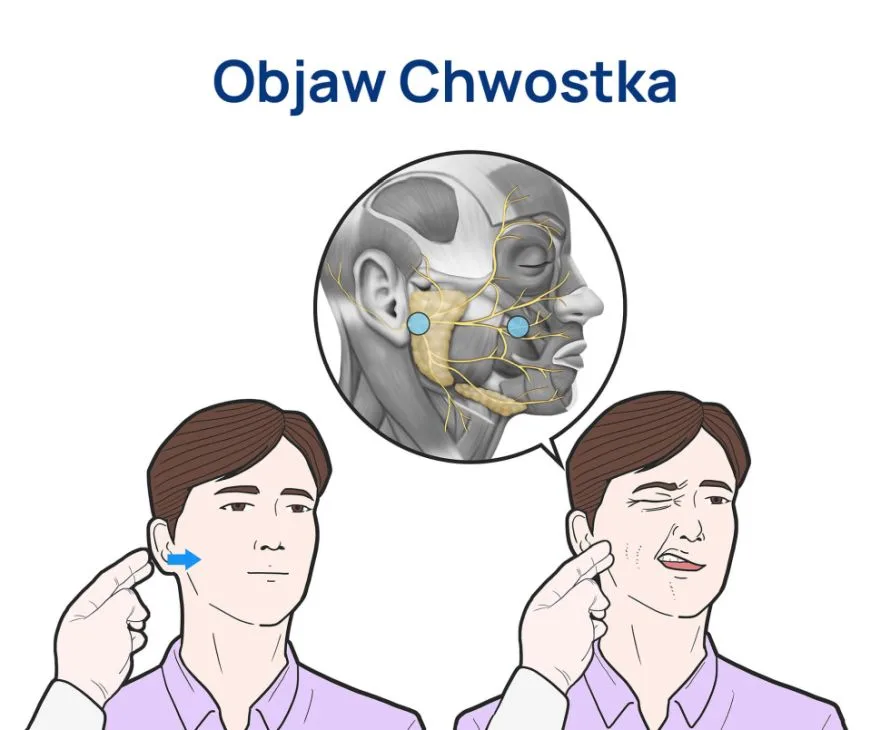
- nadmiar potasu lub wapnia,
- choroby jamy ustnej,
- kwasica ketonowa,
- przewlekła choroba nerek,
- choroby wątroby,
- krwawienie w jamie ustnej,
- choroby dziąseł.
Metaliczny posmak w ustach może być objawem zatrucia rtęcią lub ołowiem. Natomiast smak metaliczno-słodki występuje przy zatruciu miedzią.
>> Sprawdź też: Pierwiastki śmierci – kadm, rtęć, ołów
Higiena jamy ustnej a metaliczny posmak w buzi
Z powodu braku lub nieodpowiedniej higieny jamy ustnej dochodzi do zalegania resztek pokarmowych. Są one pożywką dla bakterii, które odpowiadają za rozwój próchnicy, ale też innych problemów stomatologicznych (np. chorób przyzębia, krwawienia z dziąseł). Jednym z ich objawów może być smak metalu w ustach.
Metaliczny posmak a odwodnienie
Metaliczny posmak w buzi może być jedną z oznak odwodnienia hipotonicznego. Dochodzi do niego najczęściej w sytuacji, gdy utrata wody jest uzupełniana płynami bezelektrolitowymi. Dodatkowymi objawami są: bóle głowy, nudności, zawroty głowy, kurcze mięśni, zaburzenia świadomości, tachykardia, zmniejszona elastyczność skóry, stan podgorączkowy.

Posmak metalu w ustach a niedobory mikro- i makroelementów
Posmak metalu w ustach może pojawić się u osób z niedoborami cynku lub żelaza, jako skutek uboczny stosowanego leczenia. Ponadto zaburzenia smaku obserwuje się u osób z niedoborami witaminy B12.
Metaliczny posmak w ustach w ciąży
Metaliczny posmak w ustach towarzyszy wielu ciężarnym – szczególnie w pierwszym trymestrze ciąży. Objaw ten jest związany ze zmianami hormonalnymi zachodzącymi w organizmie kobiety po zapłodnieniu. Wpływają one na całe ciało – również zmysł smaku i węchu. Metaliczny posmak w ciąży często pojawia się po spożyciu pokarmów lub współwystępuje w nudnościami i wymiotami. W większości przypadków mija samoistnie w kolejnych tygodniach ciąży. Jeżeli jednak utrzymuje się przez dłuższy czas, warto skonsultować się z lekarzem.
Posmak metalu w ustach: o jakiej chorobie może świadczyć?
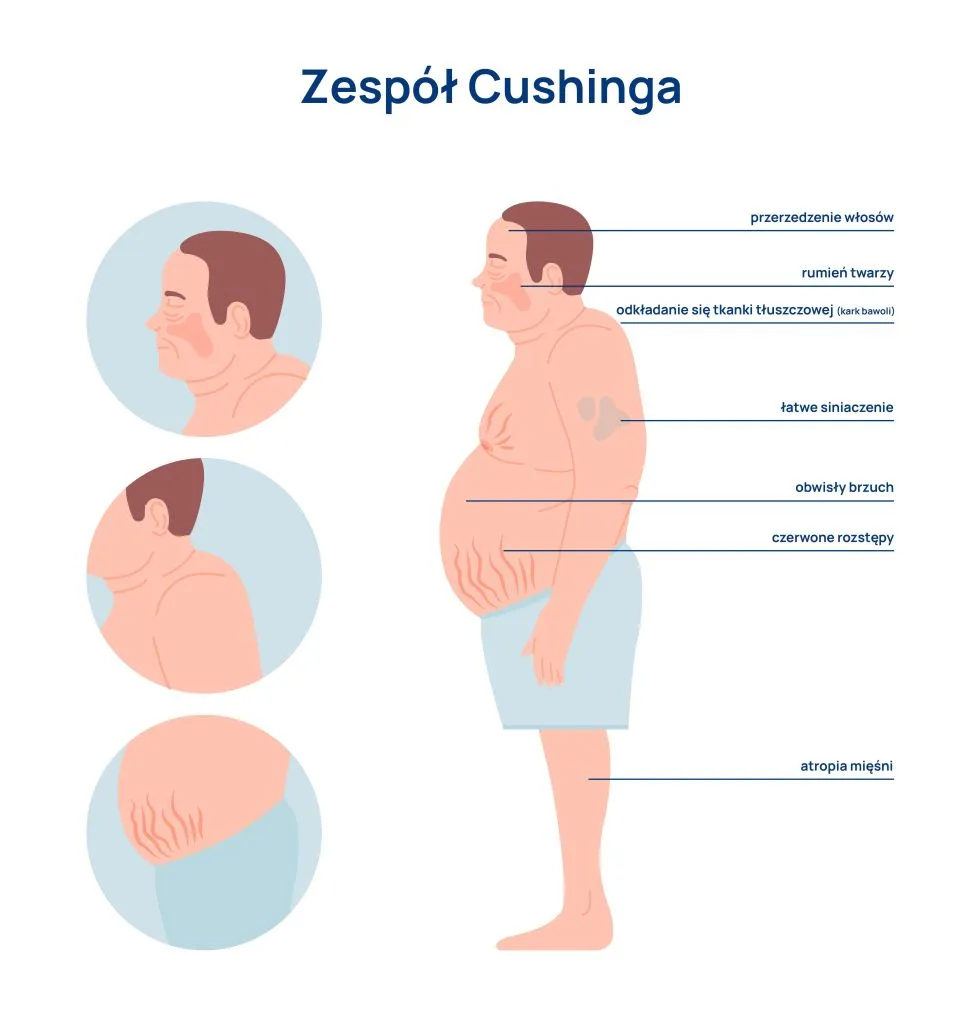
Metaliczny posmak w ustach może świadczyć również o chorobach. Objaw ten zgłasza część osób, która zmaga się z infekcją górnych dróg oddechowych, zapaleniem zatok, gardła lub grzybicą (kandydozą) jamy ustnej. Występuje on także przy problemach z wątrobą, takich jak zapalenie czy marskość wątroby. Ponadto zaburzenia smaku dotyczą większości chorych z niewydolnością nerek.
Jak pozbyć się metalicznego smaku w ustach?
Aby zredukować metaliczny posmak w ustach, należy:
- dokładnie szczotkować zęby rano i wieczorem (a w miarę możliwości również po każdym posiłku),
- czyścić przestrzenie międzyzębowe przy pomocy nici dentystycznej lub irygatora,
- regularnie czyścić język specjalną szczoteczką,
- stosować płyn do płukania jamy ustnej,
- jeść kwaśne owoce lub pić soki z kwaśnych owoców.
Jeżeli metaliczny posmak w ustach ma przyczynę chorobową, smak zwykle wraca do normy po rozpoczęciu leczenia.
Kiedy posmak metalu w ustach powinien być powodem do niepokoju?
Sporadyczna lub krótkotrwała zmiana smaku nie powinna stanowić powodu do niepokoju. Konsultacja z lekarzem jest niezbędna, jeżeli metaliczny posmak w ustach utrzymuje się przez dłuższy czas lub towarzyszą mu dodatkowe objawy, takie jak m.in.:
- nudności i wymioty,
- bóle brzucha,
- bóle zębów,
- nalot na języku lub błonach śluzowych jamy ustnej (pomimo odpowiedniej higieny),
- uczucie pieczenia w jamie ustnej,
- powiększenie węzłów chłonnych,
- niezamierzona utrata masy ciała.
Powyższe objawy wskazują na poważniejsze problemy zdrowotne, które wymagają dokładnej diagnostyki i leczenia.
Metaliczny posmak w ustach może mieć różne przyczyny – od przejściowych stanów związanych z nieprawidłową higieną jamy ustnej lub przyjmowaniem leków po poważniejsze schorzenia. Dlatego ważne jest obserwowanie swojego organizmu i skonsultowanie się z lekarzem, gdy dolegliwość utrzymuje się lub towarzyszą jej jeszcze inne objawy.
Opieka merytoryczna: lek. Kacper Staniszewski
Bibliografia
M. Abendrot i in., Opieka farmaceutyczna – witaminy i minerały, informacje niezbędne farmaceucie w prawidłowej opiece nad pacjentem, Farmacja Polska 2019, 75 (9), s. 510–518
R. Marciniak-Firadza, Istota zmysłu smaku w diagnozie i terapii logopedycznej osób dorosłych, Logopedia 2021, 50/1, s. 121–142
A. Tokajuk i in., Zespół pieczenia jamy ustnej jako problem interdyscyplinarny – przegląd piśmiennictwa, Uniwersytet Medyczny w Białymstoku. Wydział Nauk o Zdrowiu, 2014
W.Z. Pawlak, M. Wawrocka-Pawlak, Hiperkalcemia w chorobie nowotworowej, Współczesna Onkologia 2003, t. 7, nr 7, s. 482–496
M. Trojanowska-Grigoriew, L. Majkowska, Cukrzycowa kwasica ketonowa bez hiperglikemii jako powikłanie stosowania inhibitorów SGLT2, Diabetologia Praktyczna 2016, t. 2, nr 2, s. 77–83
R. Danielewicz i in., Choroba nerek a leczenie nerkozastępcze. Poradnik dla pacjentów i ich rodzin, Uniwersyteckie Centrum Kliniczne Warszawskiego Uniwersytetu Medycznego
K. Herman i in., Wpływ metali toksycznych na tkanki jamy ustnej, Journal of Education, Health and Sport 2017, 7(1), s. 209–220
I. Idasiak-Piechocka, Odwodnienie – patofizjologia i klinika, Forum Nefrologiczne 2012, t. 5, nr 1, s. 73–78
S. Younes, The impact of micronutrients on the sense of taste, https://www.sciencedirect.com/science/article/pii/S2666149723000488 (dostęp 05.07.2024)