Chłoniak grudkowy to jeden z najczęstszych nowotworów układu limfatycznego. Należy do grupy chłoniaków nieziarniczych (NHL) i zazwyczaj charakteryzuje się powolnym przebiegiem. Wiele przypadków tej choroby rozpoznaje się przypadkowo, ponieważ nie daje ona wyraźnych objawów we wczesnych stadiach. Jak długo można z nią żyć, czy daje przerzuty i jakie są rokowania? Odpowiedzi na te pytania znajdziesz w poniższym artykule.
Spis treści:
- Chłoniak grudkowy – co to za choroba?
- Przyczyny chłoniaka grudkowego
- Objawy chłoniaka grudkowego
- Diagnostyka chłoniaka grudkowego
- Leczenie chłoniaka grudkowego
- Podsumowanie
Chłoniak grudkowy – co to za choroba?
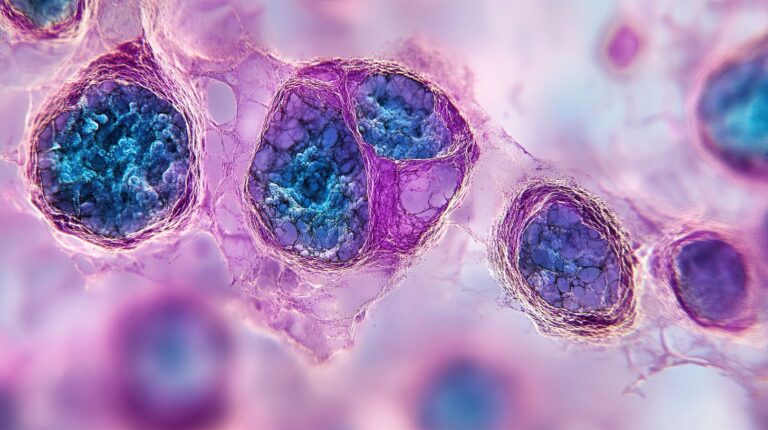
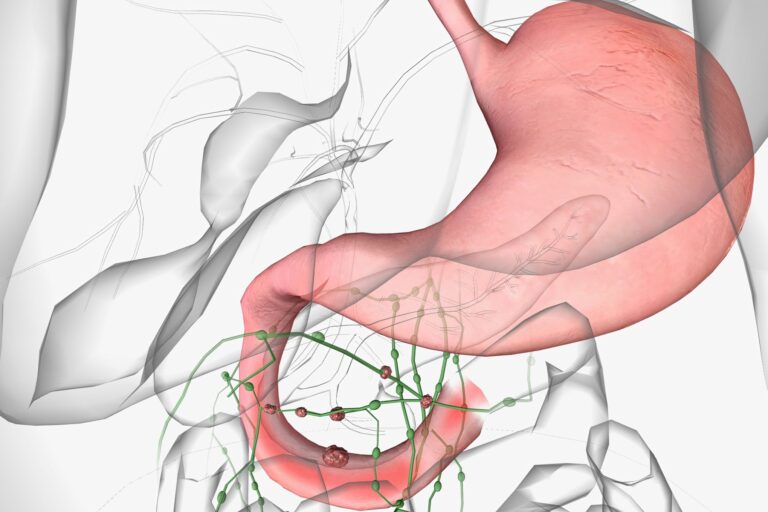
Chłoniak grudkowy (FL, follicular lymphoma) to nowotwór złośliwy wywodzący się z komórek B ośrodków rozmnażania grudek chłonnych. Ze względu na swój indolentny, czyli powoli postępujący charakter, często przez długi czas pozostaje niezauważony. Najczęściej występuje u osób po 60. roku życia i stanowi około 20% przypadków chłoniaków nieziarniczych w Europie i USA. Choroba rozwija się głównie w węzłach chłonnych, ale może także obejmować inne narządy, w tym śledzionę, szpik kostny i wątrobę.
>> Sprawdź też: Układ limfatyczny człowieka – budowa, funkcje, najczęstsze choroby
Czy chłoniak grudkowy to rak?
Mimo że chłoniak grudkowy jest nowotworem złośliwym, nie zalicza się go do typowych raków (nowotworów nabłonkowych). Jest to nowotwór układu chłonnego, który wywodzi się z limfocytów B, a nie z komórek nabłonka.
>> Zobacz również: Białaczka (leukemia, rak krwi) – objawy, rodzaje, diagnostyka i leczenie
Chłoniak grudkowy – stopnie zaawansowania
Wyróżnia się cztery stopnie zaawansowania chłoniaka grudkowego:
- Stopień I – zajęcie pojedynczej grupy węzłów chłonnych,
- Stopień II – zajęcie dwóch lub więcej grup węzłów chłonnych po jednej stronie przepony,
- Stopień III – zajęcie węzłów chłonnych po obu stronach przepony,
- Stopień IV – zajęcie narządów pozawęzłowych, takich jak szpik kostny, wątroba, płuca lub skóra.
Czy chłoniak grudkowy daje przerzuty? Chłoniak grudkowy nie tworzy przerzutów w klasycznym znaczeniu, jak np. rak płuc czy rak piersi. Jednak może się rozsiewać w obrębie układu limfatycznego, obejmując kolejne grupy węzłów chłonnych i inne narządy, takie jak szpik kostny.
Przyczyny chłoniaka grudkowego
Dokładne przyczyny rozwoju chłoniaka grudkowego nie są w pełni poznane, jednak wiadomo, że niektóre czynniki mogą zwiększać ryzyko jego wystąpienia. Wśród nich wymienia się:
- predyspozycje genetyczne i występowanie chłoniaka w rodzinie,
- mutację t(14;18), która prowadzi do nadmiernej ekspresji białka BCL2 hamującego apoptozę komórek B,
- długotrwały kontakt z substancjami chemicznymi (np. pestycydami, rozpuszczalnikami organicznymi),
- infekcje wirusowe, w tym wirusa zapalenia wątroby typu C,
- osłabienie układu odpornościowego spowodowane np. stosowaniem leków immunosupresyjnych.
Czy chłoniak grudkowy jest dziedziczny? Nie stwierdzono jednoznacznie, aby chłoniak grudkowy był chorobą dziedziczną. Występowanie tej choroby w rodzinie może nieznacznie zwiększać ryzyko jej rozwoju, ale nie jest to czynnik decydujący.
Objawy chłoniaka grudkowego
Objawy chłoniaka grudkowego mogą się różnić w zależności od stopnia zaawansowania choroby. Często pierwszym symptomem jest powiększenie węzłów chłonnych, które nie są bolesne, ale mogą zwiększać swoją objętość w czasie. Do innych objawów należą:
- nawracające infekcje wskutek osłabienia układu odpornościowego,
- przewlekłe zmęczenie i osłabienie organizmu,
- niezamierzona utrata masy ciała,
- nocne poty i gorączka powyżej 38°C,
- uczucie pełności w jamie brzusznej, jeśli chłoniak zajmie śledzionę,
- bóle kostne w przypadku zajęcia szpiku kostnego.
Diagnostyka chłoniaka grudkowego
Aby potwierdzić diagnozę chłoniaka grudkowego, lekarz może zalecić wykonanie następujących badań:
- biopsja węzła chłonnego – badanie histopatologiczne umożliwiające określenie charakteru nowotworu,
- immunofenotypowanie – analiza markerów komórkowych (CD10, CD20, BCL2) pozwalająca na rozpoznanie chłoniaka,
- badania genetyczne – wykrycie translokacji t(14;18), charakterystycznej dla tej choroby,
- badania obrazowe – PET-CT, tomografia komputerowa lub rezonans magnetyczny pomagają określić stopień zaawansowania chłoniaka,
- trepanobiopsja szpiku – inwazyjne badanie diagnostyczne polegające na pobraniu fragmentu kości wraz ze szpikiem przy użyciu specjalnej igły. Jest niezbędne do oceny zajęcia szpiku kostnego przez nowotwór i pomaga w określeniu stopnia zaawansowania choroby.



Leczenie chłoniaka grudkowego
Wybór metody leczenia zależy od stadium choroby, wieku pacjenta oraz ogólnego stanu zdrowia. Stosowane terapie obejmują:
- obserwację – w przypadkach wolno postępującej choroby, gdy pacjent nie odczuwa objawów,
- radioterapię – skuteczną w leczeniu chłoniaka w I i II stopniu zaawansowania,
- immunochemioterapię – połączenie przeciwciał monoklonalnych anty-CD20 (rytuksymab, obinutuzumab) z chemioterapią (CHOP, CVP, bendamustyna),
- terapie celowane – inhibitory kinaz PI3K, lenalidomid,
- przeszczepienie komórek macierzystych – stosowane w przypadkach nawrotowych lub opornych na leczenie.
Ile trwa leczenie chłoniaka grudkowego?
Czas leczenia zależy od stopnia zaawansowania choroby i zastosowanej terapii. Radioterapia może trwać kilka tygodni, a pełny cykl immunochemioterapii około 6 miesięcy. W przypadkach zaawansowanych pacjenci często wymagają wieloletniego monitorowania i leczenia podtrzymującego.
Jak długo żyje się z chłoniakiem grudkowym?
Wczesne stadia choroby (I i II) mogą być całkowicie wyleczone, natomiast w zaawansowanych postaciach chłoniak grudkowy jest chorobą przewlekłą. Średnia długość życia pacjentów wynosi kilkanaście lat, a nowe terapie pozwalają na jej dalsze wydłużenie.
Podsumowanie
Chłoniak grudkowy to nowotwór układu chłonnego o powolnym przebiegu, który często przez długi czas pozostaje bezobjawowy. Wczesna diagnostyka pozwala na wdrożenie skutecznego leczenia, które może obejmować radioterapię, immunochemioterapię lub terapie celowane. Mimo że zaawansowane postacie choroby nie zawsze są całkowicie wyleczalne, rozwój medycyny umożliwia długie życie z tą chorobą.
Jeśli zauważysz niepokojące objawy, takie jak powiększone węzły chłonne, przewlekłe zmęczenie czy nocne poty, skonsultuj się z lekarzem i rozważ wykonanie badań.
Bibliografia
- Freedman A.S., Aster J.C. „Clinical manifestations, pathologic features, diagnosis, and prognosis of follicular lymphoma”. UpToDate.com
- Gajewski P., Jaeschke R. „Interna Szczeklika 2024/25”.
- hematoonkologia.pl, „Chłoniak grudkowy”.