Żelazo to składnik wszystkich żywych organizmów na Ziemi, za wyjątkiem niektórych szczepów bakterii z rodzaju Lactobacillus i Bacillus. Fakt, iż żelazo jest składnikiem krwi, opisano już w XVIII wieku. Co dziś wiemy o żelazie? Jaką rolę spełnia w organizmie? Sprawdź, jakie produkty zawierają żelazo i w jakiej formie najlepiej się wchłania.
Spis treści:
- Wchłanianie żelaza w organizmie. Żelazo hemowe i niehemowe
- Rola żelaza w organizmie człowieka – za co odpowiada żelazo? Objawy niedoboru żelaza
- Zapotrzebowanie na żelazo i jego źródła w diecie
- Żelazo we krwi – jakie badania wykonać?
- Wyrównywanie poziomów żelaza w organizmie
- Rola żelaza w organizmie – podsumowanie
Wchłanianie żelaza w organizmie. Żelazo hemowe i niehemowe
Człowiek o masie 70 kg dysponuje pulą ok. 5 g żelaza. Jego zawartość w organizmie regulowana jest na poziomie wchłaniania. Organizm człowieka nie dysponuje mechanizmami, które zapewniałyby sprawne wydalanie nadmiaru żelaza. Dlatego to natura pilnuje, aby absorbować optymalne jego ilości. Dzięki temu nie dochodzi do jego nadmiernego gromadzenia w tkankach i narządach.
Wchłanianie żelaza odbywa się w dwunastnicy i jelicie cienkim. Składniki, które zwiększają wchłanianie żelaza, to:
- witamina C,
- aminokwasy – histydyna, lizyna,
- białko zwierzęce – mięso, drób, ryby,
- niskie pH soku żołądkowego (kwas solny).
Wchłanianie żelaza ograniczają z kolei:
- niektóre pierwiastki, w tym wapń, cynk, miedź, mangan, kadm, ołów,
- fosforany,
- błonnik,
- kwas szczawiowy,
- kwas fitynowy,
- białka kazeinowe i serwatkowe zawarte w mleku, przetworach mlecznych i jajach.
>> Więcej o tym, z czym można łączyć żelazo, znajdziesz w artykule: Jak łączyć witaminy i minerały?
Jakie żelazo najlepiej się wchłania?
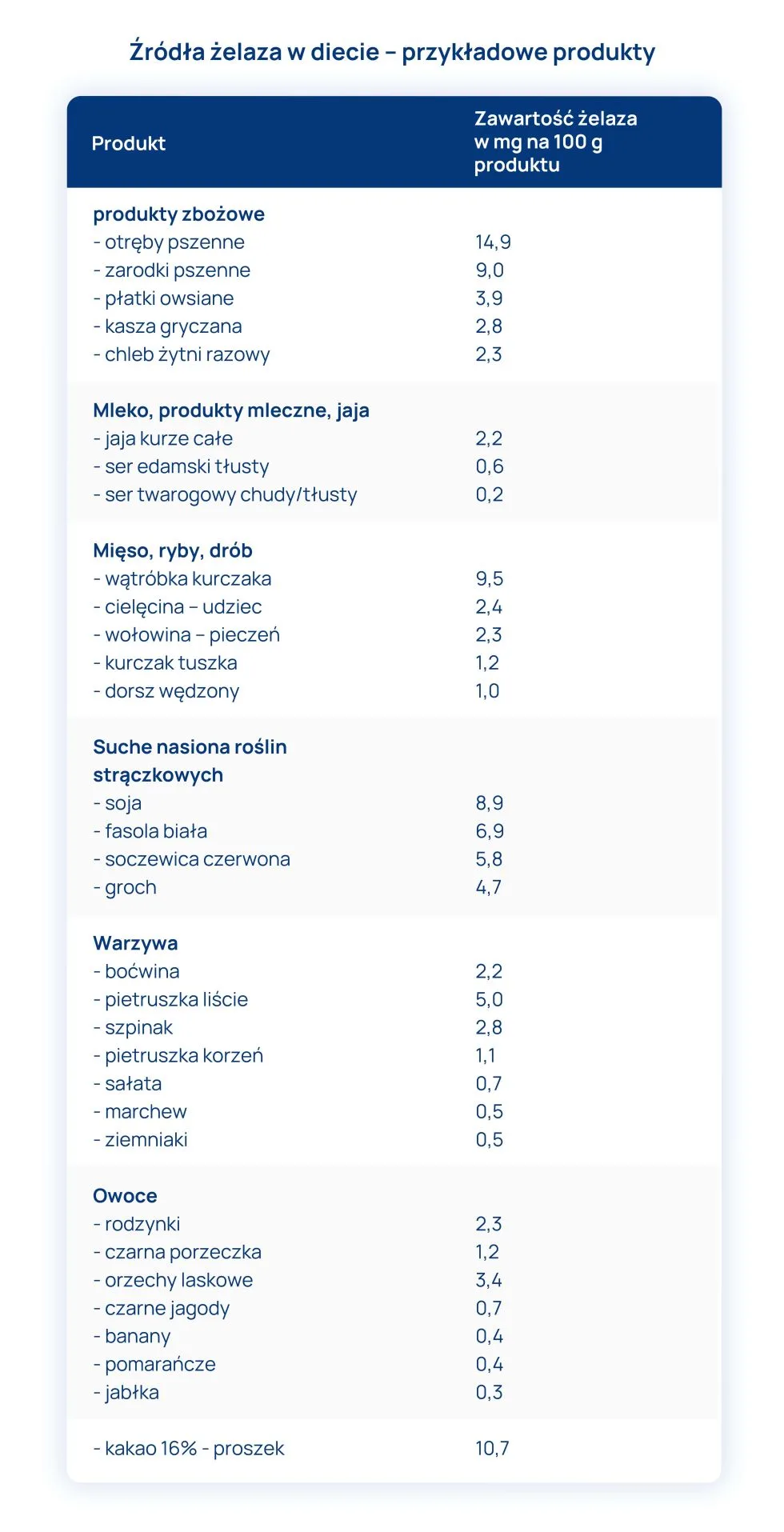
W produktach żywnościowych żelazo występuje w postaci hemowej i niehemowej. Żelazo z postaci hemowej przyswaja się w 20% (15-35%), a żelazo niehemowe w 5%.
Żelazo hemowe znajduje się w produktach odzwierzęcych. Jego większa przyswajalność wynika z tego, że występuje ono w formie gotowej do wchłaniania – na II stopniu utleniania.
Z kolei żelazo niehemowe, zawarte w produktach pochodzenia roślinnego, jest na III stopniu utleniania. Aby się wchłonęło, musi zostać zredukowane do II stopnia utleniania. To powoduje straty w jego przyswajalności. Poza tym obecne w roślinach fityniany oraz związki mineralne dodatkowo ograniczają jego wchłanianie.
Jednak produkty roślinne wciąż stanowią istotne źródło żelaza, nawet w diecie mieszanej. Jest to spowodowane jego wysoką w nich zawartością oraz powszechnością występowania (Tabela 2).
Warto wiedzieć, że żelazo z mleka kobiecego wchłania się aż w 50%.
Rola żelaza w organizmie człowieka – za co odpowiada żelazo? Objawy niedoboru żelaza.
Kluczową rolą żelaza w organizmie człowieka jest udział w transporcie tlenu z płuc do wszystkich tkanek ciała. Ponadto uczestniczy ono w łańcuchu reakcji prowadzących do powstawania prekursora serotoniny, prekursora dopaminy oraz niektórych hormonów steroidowych. Żelazo bierze udział w erytropoezie (procesie powstawania i różnicowania krwinek czerwonych), powstawaniu leukocytów i reakcjach immunologicznych.
Ze względu na pełnione w organizmie funkcje, niski poziom żelaza skutkuje niedotlenieniem i zaburzeniami systemu odpornościowego. Efektem tego jest anemia – niedokrwistość z niedoboru żelaza oraz częstsze infekcje.

Objawy niedoboru żelaza w organizmie
Objawy braku żelaza w organizmie pokrywają się z objawami anemii. Należą do nich:
- zmęczenie,
- osłabienie i zmniejszona tolerancja wysiłku,
- bóle i zawroty głowy,
- problemy z koncentracją uwagi,
- bladość skóry,
- problemy z włosami.
>> Więcej o anemii i jej przyczynach w artykule: Anemia – przyczyny, objawy i rodzaje niedokrwistości
Objawy nadmiaru żelaza w organizmie
Wydalanie żelaza z organizmu człowieka odbywa się:
- z moczem i kałem,
- w złuszczonym naskórku,
- w przypadku miesiączkujących kobiet podczas menstruacji.
Wysoki poziom żelaza zdarza się rzadko. Jest związany ze zbyt wysoką jego podażą, z suplementacją lub hemochromatozą – genetycznie uwarunkowaną chorobą, która powoduje ogólnoustrojowe przeciążenie żelazem. Nie obserwuje się toksyczności żelaza dostarczanego z pożywieniem.
Podwyższenie poziomu żelaza skutkuje odkładaniem się jego nadmiaru w komórkach miąższowych takich narządów jak:
- wątroba
- trzustka
- serca
- stawy
- skóra
- przysadka mózgowa.
Zaawansowana hemochromatoza powoduje zaburzenia funkcjonowania tych narządów i prowadzi do szeregu chorób (marskość wątroby, rak wątroby, kardiomiopatia, cukrzyca, artretyzm).
>> Przeczytaj też: Hermochromatoza – najczęstsza choroba rzadka
Zapotrzebowanie na żelazo i jego źródła w diecie
Zapotrzebowanie na żelazo jest większe u kobiet i miesiączkujących dziewcząt, wzrasta również w ciąży. Miesiączkujące kobiety narażone są na powstawanie niedoborów żelaza, dlatego szczególnie powinny dbać o to, aby dostarczać ten pierwiastek z dietą.
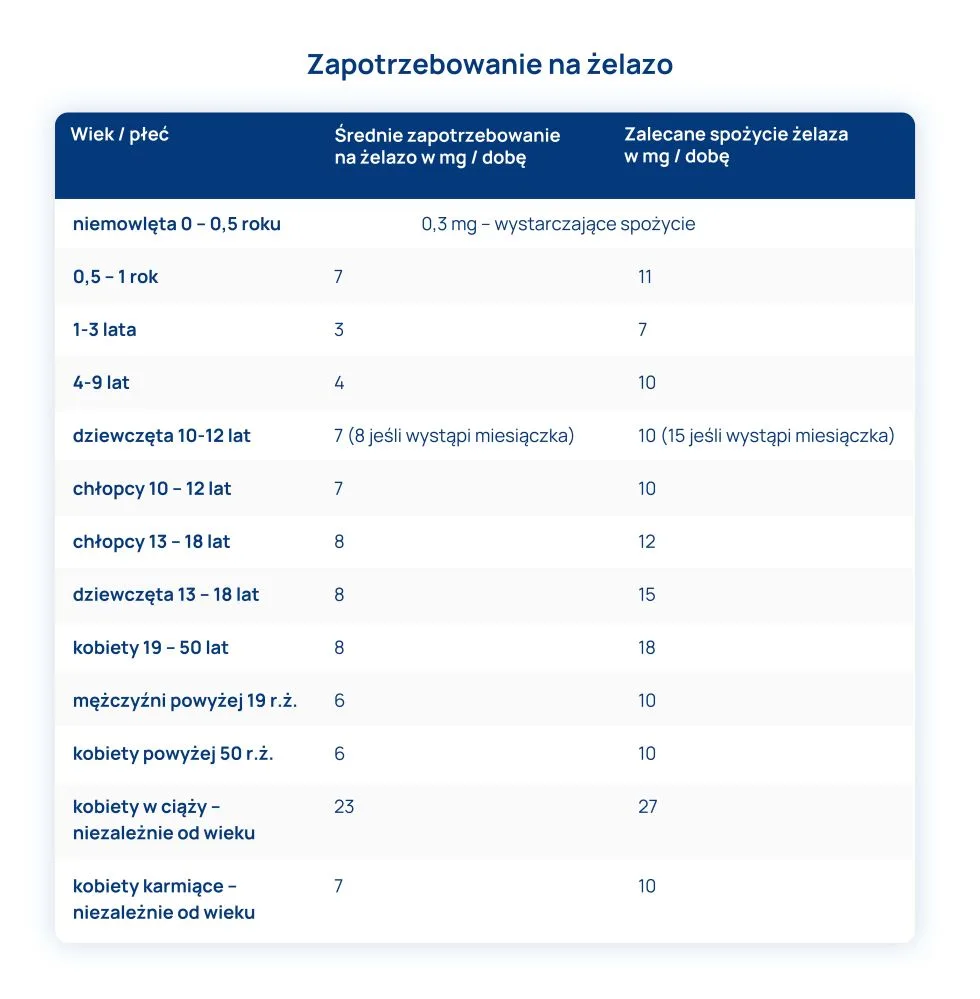
Kobiety w ciąży, aby pokryć zwiększone zapotrzebowanie płodu i łożyska (szczególnie w II i III trymestrze ciąży), powinny suplementować żelazo (najlepiej pod kontrolą badań laboratoryjnych).
Żelazo we krwi – jakie badania wykonać?
Diagnostyka gospodarki żelazowej – zarówno nadmiaru jak i niedoboru – nie opiera się na oznaczaniu tego pierwiastka we krwi. Żelazo jest magazynowane w organizmie, a zasoby magazynowe żelaza odzwierciedla ferrytyna. Sam poziom żelaza w surowicy wskazuje jego poziom dostępny na bieżące potrzeby organizmu i może być jeszcze prawidłowy, nawet wówczas, gdy magazyny są już puste. Dlatego określenie prawdziwego stanu gospodarki żelazowej wymaga oznaczenia kilku parametrów, wśród których ważna jest ferrytyna.

Pośrednim odzwierciedleniem żelaza we krwi jest stężenie hemoglobiny, która oznaczane jest w morfologii krwi. Należy sobie jednak zdawać sprawę z faktu, iż obniżony poziom hemoglobiny i niedokrwistość z niedoboru żelaza oznacza głębokie niedobory tego pierwiastka.
Organizm – nawet jeśli żelaza już zaczyna brakować – stara się kierować jak największą dostępną pulę na zabezpieczenie przenoszenia tlenu przez krew, czego odzwierciedleniem jest prawidłowa albo nieznacznie obniżona hemoglobina.

>> Szczegółowe informacje o tym, jakie badania zrobić, aby potwierdzić niedobór żelaza i w jakiej kolejności zmieniają się poszczególne parametry, dostępne są w artykule: Niedobór żelaza w organizmie
Wyrównywanie poziomów żelaza w organizmie
Prawidłowe stężenie żelaza w organizmie jest bardzo ważne, dlatego należy wiedzieć, jak radzić sobie z jego nadmiarem i niedoborem.
Jak uzupełnić niedobór żelaza w organizmie?
Bieżące uzupełnianie zapasów żelaza powinno odbywać się z codzienną dietą. Mimo że żelazo z produktów roślinnych wchłania się w mniejszych ilościach niż z produktów zwierzęcych, da się utrzymać jego prawidłowy poziom nawet na diecie wegetariańskiej. Warto skonsultować się z dietetykiem, aby mieć pewność, że dieta jest prawidłowo skomponowana. Dotyczy to zwłaszcza miesiączkujących kobiet.
W przypadku stwierdzenia niedokrwistości z niedoboru żelaza uzupełnienie tego pierwiastka z dietą jest bardzo trudne. Dlatego – w zależności od stopnia anemii – lekarz przepisuje odpowiednie leki.
Leczenie niedokrwistości jest procesem długim, bo nie da się szybko uzupełnić niedoborów (zwłaszcza jeśli są głębokie i pogłębiane obfitymi miesiączkami). W leczeniu niedokrwistości pomocna jest odpowiednia dieta.
>> Więcej o tym, jak długo trwa leczenie anemii z niedoboru żelaza i jakie preparaty są najlepiej przyswajalne, znajdziesz tu: Suplementacja i leczenie preparatami żelaza w stanach niedoborów i w niedokrwistości
Nadmiar żelaza – jak obniżyć jego poziom we krwi?
Postępowanie w przypadku nadmiaru żelaza we krwi zależy od jego przyczyny i stopnia nagromadzenia tego pierwiastka. W przypadku pacjentów z hemochromatozą postępowaniem leczniczym są upusty krwi, wykonywane u chorych okresowo, w zależności od poziomu ferrytyny. Ilość upuszczanej u danego pacjenta krwi ustalana jest indywidualnie, w zależności od stanu chorego i schorzeń współistniejących.
Rola żelaza w organizmie – podsumowanie
Żelazo to pierwiastek bardzo ważny dla funkcjonowania organizmu człowieka. Niedobór żelaza jest jednym z częstszych niedoborów w populacji, co związane jest z fizjologią kobiety. Dlatego informacje o tym jak funkcjonuje obrót żelazem, jak chronić się przed anemią i jak wygląda leczenie, stanowią jeden z fundamentów profilaktyki zdrowotnej.
Bibliografia:
- Ciborowska H., Rudnicka A., Dietetyka. Żywienie zdrowego i chorego człowieka. Wydawnictwo Lekarskie PZWL, Warszawa 2015.
- Gertig H., Przysławski J., Bromatologia. Zarys nauki o żywności i żywieniu. Wydawnictwo Lekarskie PZWL, Warszawa 2015
- Normy żywienia dla populacji Polski i ich zastosowanie – pod red. M. Jarosza, E. Rychlik, K. Stoś, J. Charzewskiej Narodowy Instytut Zdrowia Publicznego – Państwowy Zakład Higieny, 2020