Hipercholesterolemia rodzinna to schorzenie, które może mieć poważny wpływ na zdrowie. Dowiedz się, jakie są objawy tej choroby i jak się ją leczy.
Spis treści:
- Czym hipercholesterolemia rodzinna?
- Hipercholesterolemia rodzinna – objawy choroby
- Hipercholesterolemia rodzinna – diagnostyka i badania
- Hipercholesterolemia rodzinna – leczenie
- Dieta w hipercholesterolemii rodzinnej
- Hipercholesterolemia rodzinna – podsumowanie
Czym hipercholesterolemia rodzinna?
Hipercholesterolemia to stan, w którym podwyższeniu ulega stężenie cholesterolu o niskiej gęstości (LDL, low density lipoprotein). Większość przypadków jest nabytych, będących skutkiem niehigienicznego trybu życia.
Istnieją jednak postaci rodzinne, w których mutacje genetyczne skutkują bardzo wysokimi wartościami LDL. Szczegółowy i bardzo przystępny opis tej grupy chorób znajdziesz w naszej bazie: Hipercholesterolemia rodzinna.
Hipercholesterolemia rodzinna – objawy choroby
Pacjenci z hipercholesterolemią rodzinną przez wiele lat mogą nie odczuwać dolegliwości. Choroba wywołuje jednak objawy, z których część jest subtelna. W przebiegu choroby mogą pojawić się:
- kępki żółte,
- bóle i zapalenia stawów,
- zmiany na rogówce (tzw. łuk rogówkowy),
- ostre incydenty sercowo-naczyniowe (np. zawał serca, udar mózgu, nagły zgon) i wady zastawkowe serca.
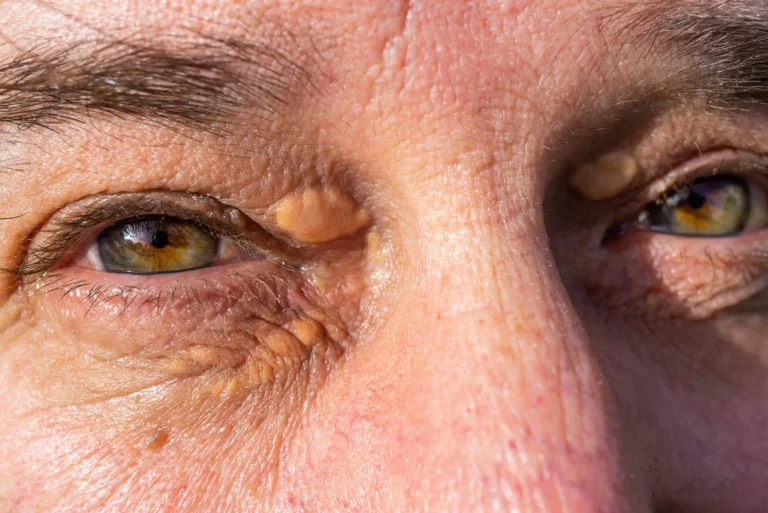
Kępki żółte (żółtaki skórne) jako objaw hipercholesterolemii rodzinnej
Kępki żółte, inaczej żółtaki, to grudkowe, niewielkie zmiany skórne, które najczęściej lokalizują się na powiekach. Mogą też obejmować inne lokalizacje skórne, a nawet ścięgna prostowników palców lub wzdłuż ścięgna Achillesa.
Ich powstawanie jest skutkiem pochłaniania nadmiaru cholesterolu przez komórki żerne – makofagi. Występowanie dużej liczby kępek, niekiedy zlewających się w większe skupiska, nosi nazwę żółtakowatości.
Bóle i zapalenia stawów
Ten objaw pojawia się w rodzinnej hipercholesterolemii typu IIa i jest rzadko spotykany. Ból i zapalenie obejmują zazwyczaj wiele stawów, mogą dotyczyć także ścięgien. Ich powstawanie jest prawdopodobnie związane ze zwiększoną aktywnością makrofagów.
Zmiany na rogówce
Odkładanie się lipidów w rogówce może powodować powstanie zmian w obrębie tego narządu opisywane jako łuk rogówkowy (arcus cornealis). Jest to nic innego jak biały, szary lub niebieski nieprzezroczysty pierścień na brzegu rogówki, bogaty w lipidy, głównie zewnątrzkomórkowy depozyt.
Ostre incydenty sercowo-naczyniowe
Wysoki poziom cholesterolu jest jednym z najsilniejszych czynników ryzyka sercowo-naczyniowego. U pacjentów z heterozygotyczną postacią choroby stężenie cholesterolu całkowitego może mieścić się w zakresie 350–550 mg/dl, podczas gdy postać homozygotyczna prowadzi do zakresu od 600 do nawet ponad 1000 mg/dl.
Sprawia to, że naczynia krwionośne znacznie szybciej ulegają zmianom miażdżycowym. Prowadzi to do zwiększonego ryzyka choroby niedokrwiennej serca, zawału, udaru mózgu, a nawet zgonu, które mogą pojawić się już w młodym wieku.
Nieco częściej niż w populacji ogólnej dochodzi do zwężenia zastawki aortalnej lub tętniaka aorty brzusznej. Dzięki ogromnemu postępowi w zakresie leczenia w ostatnich latach granica wiekowa występowania tych zdarzeń u osób z hipercholesterolemią rodzinną znacznie się wydłużyła.
Hipercholesterolemia rodzinna – diagnostyka i badania
Podstawą do rozpoznania hipercholesterolemii jest oznaczenie lipidogramu – stężenia całkowitego cholesterolu, frakcji HDL, LDL i trójglicerydów.

Jak już wspomniano, pod uwagę należy brać też nieproporcjonalnie wysokie dla wieku, wzrostu i masy ciała wartości cholesterolu LDL i/lub obciążenie rodzinne ciężkimi postaciami hipercholesterolemii (potwierdzone badaniami) bądź zgony z powodów sercowo-naczyniowych w młodym wieku.
Według Amerykańskiej Akademii Pediatrii lekarze podstawowej opieki zdrowotnej powinni badać dzieci w dwóch punktach czasowych: w wieku 9–11 lat i ponownie w wieku 17–21 lat. Zgodnie z wytycznymi panelu ekspertów NCEP ATP III (National Cholesterol Education Program Adult Treatment Panel III) wszyscy dorośli powinni poddać się badaniom przesiewowym w wieku powyżej 20 lat.
W rodzinach, w których występuje potwierdzone zachorowanie na rodzinną hipercholesterolemię lub przedwczesna wada zastawkowa serca, badania przesiewowe należy rozpocząć już w wieku 2 lat.
Nie zaleca się wykonywania badań przesiewowych przed ukończeniem 2. roku życia. Hipercholesterolemię rodzinną należy podejrzewać u dzieci i młodych dorosłych, gdy stężenie LDL-C na czczo wynosi powyżej 160 mg/dl, a u dorosłych, gdy powyżej 190 mg/dl.
Hipercholesterolemia rodzinna – badania genetyczne
Rozpoznanie choroby opiera się zazwyczaj na podwyższeniu cholesterolu całkowitego, LDL i nie-HDL powyżej 95. centyla zalecanego dla wieku i płci pacjenta, wraz z dodatnim wywiadem rodzinnym lub identyfikacją mutacji sprawczej. Mutacje genów wykrywa się jedynie u 60–70% osób, u których na podstawie kryteriów klinicznych zdiagnozowano określoną lub prawdopodobną hipercholesterolemię rodzinną. Badania genetyczne obejmują ocenę potencjalnych mutacji w genach LDLR, APOB i PCSK9.

Pozostałe badania
Podczas oceny pacjenta z podejrzeniem hipercholesterolemii rodzinnej niezwykle ważne jest wykluczenie wtórnych przyczyn zwiększonego stężenia LDL, takich jak niedoczynność tarczycy, zespół nerczycowy i choroby wątroby.
Stąd w celu kompleksowej oceny zalecane jest oznaczenie:
- parametrów funkcjonowania tarczycy: TSH, fT4,
- kreatyniny, elektrolitów,
- badania ogólnego moczu,
- stężenia glukozy na czczo,
- aminotransferaz: ALT i AST.

Hipercholesterolemia rodzinna – leczenie
Cele leczenia hipercholesterolemii zależą od współistnienia pozostałych czynników ryzyka sercowo-naczyniowego – im jest ich więcej tym bardziej agresywnie dąży się do obniżenia LDL. Chorzy z rozpoznaną hipercholesterolemią rodzinną, którzy nie posiadają dodatkowych czynników ryzyka, i tak są o wiele bardziej narażeni na poważne powikłania.
Stąd celem terapii jest uzyskanie poziomu LDL poniżej 70 md/dl, a w przypadku wartości wyjściowo bardzo wysokich dąży się do obniżenia o 50% w stosunku do poziomu bazowego. Pacjenci, którzy posiadają inne czynniki ryzyka (np. palą papierosy), powinni osiągać stężenie docelowe na poziomie poniżej 55 mg/dl.
Leczenie opiera się głównie o postępowanie dietetyczne (o tym w kolejnym punkcie), modyfikację stylu życia i farmakoterapię. Najpowszechniej stosowaną i łatwo dostępną grupą leków są statyny, które hamują enzymy odpowiedzialne za powstawanie cząsteczek prekursorowych dla cholesterolu. Można je łączyć z ezetymibem, który wybiórczo blokuje wchłanianie cholesterolu oraz pochodnych steroli roślinnych w jelitach.
W przypadkach homozygotycznych (z reguły ciężkich) postaci hipercholesterolemii rodzinnej od niedawna dostępne są tzw. inhibitory PCSK9, grupa leków biologicznych, które blokują receptory dla lipoprotein o niskiej gęstości na komórkach wątroby. Są one jednak bardzo drogie i trudno dostępne.
Dieta w hipercholesterolemii rodzinnej
Pacjenci powinni stosować dietę niskotłuszczową i niskocholesterolową. Zgodnie z wytycznymi NCEP ATP III nie więcej niż 25–35% dziennej dawki kalorii powinno pochodzić z tłuszczów, w tym poniżej 7% z tłuszczów nasyconych.
Należy całkowicie unikać tłuszczów trans (obecnych np. w margarynie). Spożycie cholesterolu powinno być ograniczone do mniej niż 200 mg dziennie. Pacjenci mogą również odnieść korzyść z dodatku 2 g steroli roślinnych i 10-20 g rozpuszczalnego błonnika dziennie.
Oprócz tych zmian w diecie pacjentom zaleca się utrzymywanie prawidłowej masy ciała i unikanie palenia tytoniu (ten ostatni stanowi bardzo silny czynnik ryzyka sercowo-naczyniowego!).
Hipercholesterolemia rodzinna – podsumowanie
Hipercholesterolemia rodzinna jest poważną chorobą, która znacznie podnosi ryzyko groźnych powikłań w młodym wieku. Rozpoznanie opiera się o spełnienie szeregu kryteriów, z których podstawowym jest stężenie cholesterolu LDL na czczo. Rozpoznanie może, ale nie musi być potwierdzone badaniem genetycznym. Leczenie obejmuje postępowanie dietetyczne, aktywność fizyczną i farmakoterapię. Pamiętaj, że ta choroba może nie dawać żadnych objawów – wykonując proste i tanie oznaczenie lipidogramu możesz dowiedzieć się, czy należy ją podejrzewać także u Ciebie. Spraw sobie prezent, zadbaj o zdrowie i zbadaj się.
Źródła
Zubielienė K, Valterytė G, Jonaitienė N, Žaliaduonytė D, Zabiela V. Familial Hypercholesterolemia and Its Current Diagnostics and Treatment Possibilities: A Literature Analysis. Medicina (Kaunas). 2022 Nov 17;58(11):1665. doi: 10.3390/medicina58111665. PMID: 36422206; PMCID: PMC9692978.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9692978/
Pejic RN. Familial hypercholesterolemia. Ochsner J. 2014 Winter;14(4):669-72. PMID: 25598733; PMCID: PMC4295745.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4295745/
Warden BA, Fazio S, Shapiro MD. Familial Hypercholesterolemia: Genes and Beyond. [Updated 2021 Oct 23]. In: Feingold KR, Anawalt B, Blackman MR, et al., editors. Endotext [Internet]. South Dartmouth (MA): MDText.com, Inc.; 2000-. Available from: https://www.ncbi.nlm.nih.gov/books/NBK343488/
Ison HE, Clarke SL, Knowles JW. Familial Hypercholesterolemia. 2014 Jan 2 [Updated 2022 Jul 7]. In: Adam MP, Feldman J, Mirzaa GM, et al., editors. GeneReviews® [Internet]. Seattle (WA): University of Washington, Seattle; 1993-2024. Available from: https://www.ncbi.nlm.nih.gov/books/NBK174884/
Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC National Cardiac Societies; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021 Sep 7;42(34):3227-3337. doi: 10.1093/eurheartj/ehab484. Erratum in: Eur Heart J. 2022 Nov 7;43(42):4468. doi: 10.1093/eurheartj/ehac458. PMID: 34458905.
https://academic.oup.com/eurheartj/article/42/34/3227/6358713?login=false
Varghese MJ. Familial hypercholesterolemia: A review. Ann Pediatr Cardiol. 2014 May;7(2):107-17. doi: 10.4103/0974-2069.132478. PMID: 24987256; PMCID: PMC4070199.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4070199/
Fernández A, Sorokin A, Thompson PD. Corneal arcus as coronary artery disease risk factor. Atherosclerosis. 2007 Aug;193(2):235-40. doi: 10.1016/j.atherosclerosis.2006.08.060. Epub 2006 Oct 17. PMID: 17049531.
https://pubmed.ncbi.nlm.nih.gov/17049531/