Zakażenia pasożytnicze dotyczą w dużym stopniu układu pokarmowego, w szczególności jelit, ale również miąższu płuc. Są to infekcje rodzime lub zawleczone z innych krajów, np. tropikalnych. W artykule poruszamy najważniejsze aspekty chorób pasożytniczych układu oddechowego – jakie pasożyty atakują płuca, jakie towarzyszą temu objawy, a także jak wygląda zapobieganie, leczenie i diagnostyka.
Spis treści:
- Rodzaje pasożytów w płucach
- Choroby pasożytnicze układu oddechowego – przyczyny
- Pasożyty w płucach – objawy
- Robaki w płucach u człowieka – jak wygląda diagnostyka?
- Pasożyty w płucach – jak wygląda leczenie?
- Choroby pasożytnicze w płucach – podsumowanie
Rodzaje pasożytów w płucach
Płuca są miejscem bytowania (biotopem) dla wielu pasożytów, które należą do kilku grup. Są to:
- pierwotniaki, np. pełzak czerwonki;
- płazińce, np. przywra płucna;
- nicienie, np. glista psia.
Inną grupą pasożytów, roznoszonych przez komary, które atakują płuca, są tzw. filarie (Wuchereriabancrofti, Brugia malayi, Mansonellaozzardi i Dirofilariaimmitis) wywołujące filariozy. Występują przede wszystkim w krajach ciepłych i tropikalnych Azji, Ameryki Środkowej i Południowej oraz Afryki.
Choroby pasożytnicze układu oddechowego – przyczyny
Pasożyty zajmujące płuca, którymi człowiek zaraża się drogą pokarmową to:
- Ascarislumbricoides (glista ludzka) – bytuje w jelicie cienkim, ale również w płucach,
- Echinocoocusgranulosus i E. multilocularis (tasiemiec bąblowcowy i bąblowiec wielojamowy) – atakujągłównie wątrobę i płuca (w przypadku E. granulosus– 60% wątroba, 20% płuca);
- Paragonimuswestermani – przywra płucna (osiedla się w miąższu płuc, a przebieg kliniczny paragonimozy przypomina gruźlicę);
- Toxocaracanis i T. cati (glista psia i g. kocia) – najczęściej bytują w wątrobie i płucach (postać trzewna toksokarozy).

Tropikalnym pasożytempłuc jest węgorek jelitowy, który przenika przez skórę, np.stóp i wywołuje węgorczycę.
Osoby podróżujące w rejony endemiczne, w których występują choroby charakterystyczne dla danego regionu (np. malaria w obszarze środkowej i południowej Afryki), są narażone na pasożytnicze zakażenia płuc i innych narządów. Mogą być wywołane przez:
- Entamoebahistolytica (pełzak czerwonki – zajmuje jelito grube, wątrobę, mózg oraz płuca);
- Plasmodiumspp. (zarodziec, np. P. vivax – z. ruchliwy, P. ovale – z. owalny oraz P. malariae – z. pasmowy).

>> Zobacz również: Co to jest malaria?
| Warto wiedzieć: Dla niektórych pasożytów płuca stanowią główny biotop (np. dla przywry płucnej), a dla części –poboczny (np. u tęgoryjca, gdzie dochodzi do fazy migracji przez układ krwionośny i płuca). |
Pasożyty w płucach – jak zapobiec zakażeniu?
Najważniejszą rzeczą jest zachowanie zasad higieny, które ograniczają możliwość przeniesienia postaci inwazyjnej, np. jaja, larwy, cysty do organizmu gospodarza drogą pokarmową. Dlatego należy pamiętać o:
- regularnym i higienicznym myciu rąk, np.w szczególności po zabawie ze zwierzętami;
- dokładnym myciu pokarmów przed ich spożyciem, w tym zbiorów z lasu (jagody);
- unikaniu spożycia pokarmów i napojów z niepewnych źródeł, np. straganów ulicznych i niebutelkowanej wody.
W zapobieganiu chorób pasożytniczych pomoże regularne odrobaczanie zwierząt domowych.
>> To Cię zainteresuje: Jak skutecznie myć ręce – higiena rąk
| Warto wiedzieć: W przypadku wyjazdu w rejon tropikalny należy zaopatrzyć się w stosowne repelenty (przed owadami i właściwy ubiór, spać pod moskitierą oraz unikać chodzenia boso po ziemi (może być skażona postaciami inwazyjnymi pasożytów). |
Pasożyty w płucach – objawy
Objawy zakażeń pasożytniczych w płucach to:
- kaszel (napadowy);
- duszność (często narastająca, związana z gromadzącym się wysiękiem w pęcherzykach płucnych);
- odkrztuszanie, świszczący oddech;
- gorączka;
- uporczywy ból gardła;
- osłabienie, złe samopoczucie, bóle głowy;
- bóle brzucha, nudności i wymioty.
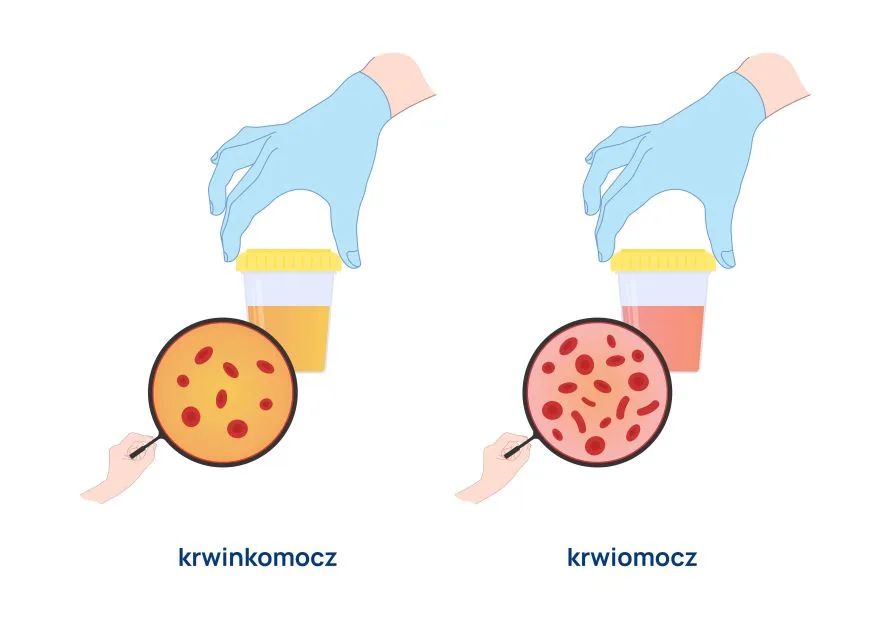
W przypadku niektórych filarioz stwierdza się krwioplucie i ból opłucnowy.Echinococcisgranulosus może powodować zanik i degenerację tkanek, np. wątroby i płuc, co jest związane z uciskiem wywieranym przez pasożyta.
Zakażenia pasożytnicze zwiększają ryzyko wtórnej infekcji bakteryjnej płuc.

Robaki w płucach u człowieka – jak wygląda diagnostyka?
Podstawą każdego rozpoznania jest wywiad lekarski i określenie potencjalnych źródeł zarażenia, np. kontakt z dzikimi zwierzętami, zaniedbanymi zwierzętami domowymi czy podróże w rejony endemiczne.
W diagnostyce pasożytów płucnych wykorzystuje się również badania laboratoryjne, np.:
- morfologię krwi – można w niej zaobserwować wzrost liczby granulocytów kwasochłonnych (eozynofilów), czyli eozynofilię;
- testy serologiczne,metody PCR i rtPCR.

Oprócz tego wykorzystuje się badania obrazowe klatki piersiowej (RTG, TK i MR), w których mogą uwidocznić się zmiany zapalne, torbiele z pasożytami w płucach oraz inne.
Lekarz może wykorzystać również badanie:
- kału (np. w przypadku pasożytów bytujących w jelitach i płucach);
- plwociny (w diagnostyce przywry płuc, askariozy płucnej – masowej inwazji glisty ludzkiej, która powoduje objawy płucne);
- płynu z torbieli pobieranego na drodze biopsji aspiracyjnej cienkoigłowej (np. w przypadku tasiemca bąblowcowego).
- oraz wielu innych badań pomocniczych przy stawianiu diagnozy.
Niekiedy biopsja jest niewskazana ze względu na możliwość rozsiania przerzutów, bądź perforacji zbiornika jak w przypadku bąblowca wielojamowego.
| Czy wiesz, że… glista ludzka dostaje się do organizmu przez spożycie jaj w skażonej żywności lub wodzie? Larwy przedostają się z jelit do krwiobiegu, wędrują do płuc, są odkasływane i połykane, trafiając do jelit, gdzie dorastają i składają jaja wydalane z kałem. |
>> Zobacz również: Co to jest tasiemczyca i jakie powoduje objawy u ludzi?
Pasożyty w płucach – jak wygląda leczenie?
Leczenie chorób pasożytniczych płuc polega na zastosowaniu terapii przeciwpasożytniczej, w której wykorzystuje się m.in. albendazol, mebendazol, tiabendazol, pyrantel. Oprócz tego wykorzystuje się chirurgiczne usuwanie pasożytów, np. w przypadku obecności torbieli w płucach lub laparotomii, jeśli doszło do zaczopowania światła jelita lub dróg żółciowych.
Zależnie od patogenu stosuje się je przez 1-3 tygodnie, a cykl leczenia powtarza się.
Choroby pasożytnicze w płucach – podsumowanie
Płuca są jednym z narządów, które mogą zasiedlać pasożyty – stanowi to dla wielu z nich docelowe lub poboczne miejsce bytowania. Powodują mało specyficzne objawy, np. kaszel, świsty oddechowe, gorączkę i ból gardła. Pasożyty to nieoczywiste przyczyny zaburzeń ze strony układu oddechowego. Niezależnie od tego objawy te wymagają odpowiedniej diagnostyki, w skład której mogą znaleźć się badania parazytologiczne, np. kału i plwociny, a z racji umiejscowienia również badania obrazowe, np. radiologiczne płuc.
Opieka merytoryczna: lek. Kacper Staniszewski
Bibliografia
- Morozińska-Gogol J (2016) Parazytologia medyczna. Kompendium, Warszawa: PZWL
- https://podyplomie.pl/wiedza/wielka-interna/1063,pasozytnicze-choroby-pluc, dostęp 12.07.2024
- https://www.mp.pl/pacjent/pediatria/choroby/ukladoddechowy/144235,choroby-pasozytnicze-ukladu-oddechowego, dostęp 12.07.2024