Miopatie zapalne to grupa przewlekłych chorób autoimmunologicznych, w których układ odpornościowy atakuje mięśnie, prowadząc do ich zapalenia i osłabienia. Objawy tych schorzeń są zróżnicowane i mogą dotyczyć nie tylko mięśni, ale także innych narządów, takich jak skóra, stawy, płuca czy serce. Miopatie zapalne mogą znacząco pogarszać jakość życia pacjentów, a w niektórych przypadkach stanowić zagrożenie dla ich i życia.
Spis treści:
- Miopatie zapalne – co to za schorzenia?
- Miopatie zapalne a nowotwory
- Objawy miopatii zapalnych
- Miopatie zapalne – diagnostyka przeciwciał
- Miopatie zapalne – metody leczenia
- Podsumowanie
Miopatie zapalne – co to za schorzenia?
Idiopatyczne zapalne miopatie (ang. idiopathic inflammatory myopathies,IIM) to grupa chorób autoimmunologicznych,w których układ odpornościowy atakuje włókna mięśniowe, prowadząc do ich zapalenia. Towarzyszą im bardzo zróżnicowane objawy kliniczne. Ponadto, w poszczególnych przypadkach odmiennie może przebiegać odpowiedź na leczenie i inne może być rokowanie. Chociaż osłabienie mięśni jest zazwyczaj głównym objawem, inne narządy, takie jak skóra, stawy, płuca, serce i przewód pokarmowy, również mogą zostać zajęte, a czasami to właśnie te objawy dominują, co potwierdza, że IIM są chorobami zapalnymi o charakterze układowym.
Miopatie zapalne często są poważnymi chorobami, które mogą zagrażać życiu pacjenta.Są to schorzenia przewlekłe, skłonne do nawrotów, które znacząco pogarszają jakość życia osób na nie cierpiących.Ze względu na zróżnicowany obraz kliniczny badania laboratoryjne odgrywają kluczową rolę w postawieniu właściwego rozpoznania.
Postaci miopatii zapalnych
Na podstawie różnych cech klinicznych, histopatologicznych i serologicznych, IIM dzieli się na 4 główne typy:
- zapalenie skórno-mięśniowe (ang. dermatomyositis, DM),
- zapalenie wielomięśniowe (ang. polymyositis,PM),
- wtrętowe zapalenie mięśni (ang. inclusion body myositis,IBM),
- martwicze autoimmunologiczne zapalenie mięśni (ang. necrotising autoimmune myopathy, NAM).
Do miopatii zapalnych zalicza się również młodzieńcze zapalenie skórno-mięśniowe. Jest to rzadka choroba autoimmunologiczna, która występuje u dzieci, zazwyczaj poniżej 16. roku życia.
Objawy, leczenie i rokowania, różnią się w zależności od typu miopatii. Ze względu na dość ciężki przebieg choroby, sprawna i precyzyjna diagnostyka IIM jest kluczowa. Badanie autoprzeciwciał stanowi bardzo cenne narzędzie, które pozwala na rozróżnienie typów miopatii zapalnych trudnych do odróżnienia na podstawie objawów klinicznych oraz na ustalenie prawidłowej diagnozy. Autoprzeciwciała występujące u pacjentów chorujących na miopatie zapalne dzieli się na przeciwciała swoiste dla zapalenia mięśni (ang. myositis specific antibodies, MSA) oraz przeciwciała związane z zapaleniem mięśni (ang. myositis-associated antibodies, MAA).
Miopatie zapalne a nowotwory
Miopatie związane z nowotworem są również uważane w niektórych źródłach za odrębny podtyp miopatii. Stanowią one prawie połowę wszystkich przypadków IIM (z wyłączeniem wtrętowego zapalenia mięśni) u osób powyżej 65. roku życia, ale mniej niż 10% w młodszych populacjach. Ostatnia metaanaliza pacjentów z PM lub DM wykazała silny związek pomiędzy tymi chorobami a nowotworami. U kobiet najczęstsze są nowotwory piersi i jajników, podczas gdy u mężczyzn dominują nowotwory płuc i prostaty. Inne nowotwory to chłoniaki, rak jelita grubego, trzustki i pęcherza moczowego.Z tego względu, pacjentom chorującym na miopatie zapalne zaleca się regularne badania przesiewowe w kierunku nowotworów.


Pacjentom z miopatiami zapalnymi rekomenduje się wykonanie tomografii komputerowej klatki piersiowej i brzucha, ultrasonografii miednicy oraz mammografii u kobiet. Mężczyznom zaleca się ultrasonografię jąder, a zarówno mężczyznom, jak i kobietom powyżej 50. roku życia – kolonoskopię. W przypadku negatywnego wyniku pierwszego badania przesiewowego, zaleca się jego powtórzenie po 3–6 miesiącach, a następnie regularne wykonywanie kolejnych badań co 6 miesięcy przez okres 4 lat. Pomocne może być również okresowe badanie markerów nowotworowych.
>> Przeczytaj też: Czym są markery nowotworowe i jakich dostarczają informacji?
Objawy miopatii zapalnych
Większość miopatii zapalnych, z wyjątkiem wtrętowego zapalenia mięśni (IBM), objawia się osłabieniem mięśni proksymalnych (mięśnie zlokalizowane najbliżej tułowia, łącznie z górną częścią nóg, biodrami, górną częścią rąk, ramionami oraz samym tułowiem). Pacjenci mogą skarżyć się na narastające trudności z wstawaniem z krzesła, wchodzeniem po schodach, myciem włosów czy podnoszeniem przedmiotów. Czynnościom tym może towarzyszyć ból mięśni i ich tkliwość. U niektórych pacjentów rozwija się duszność związana ze śródmiąższową chorobą płuc lub osłabieniem mięśni oddechowych, zaburzenia połykania, wynikające z zajęcia przełyku lub gardła, niewydolność serca lub arytmia z powodu zapalenia mięśnia sercowego, a także krwawienia z przewodu pokarmowego.
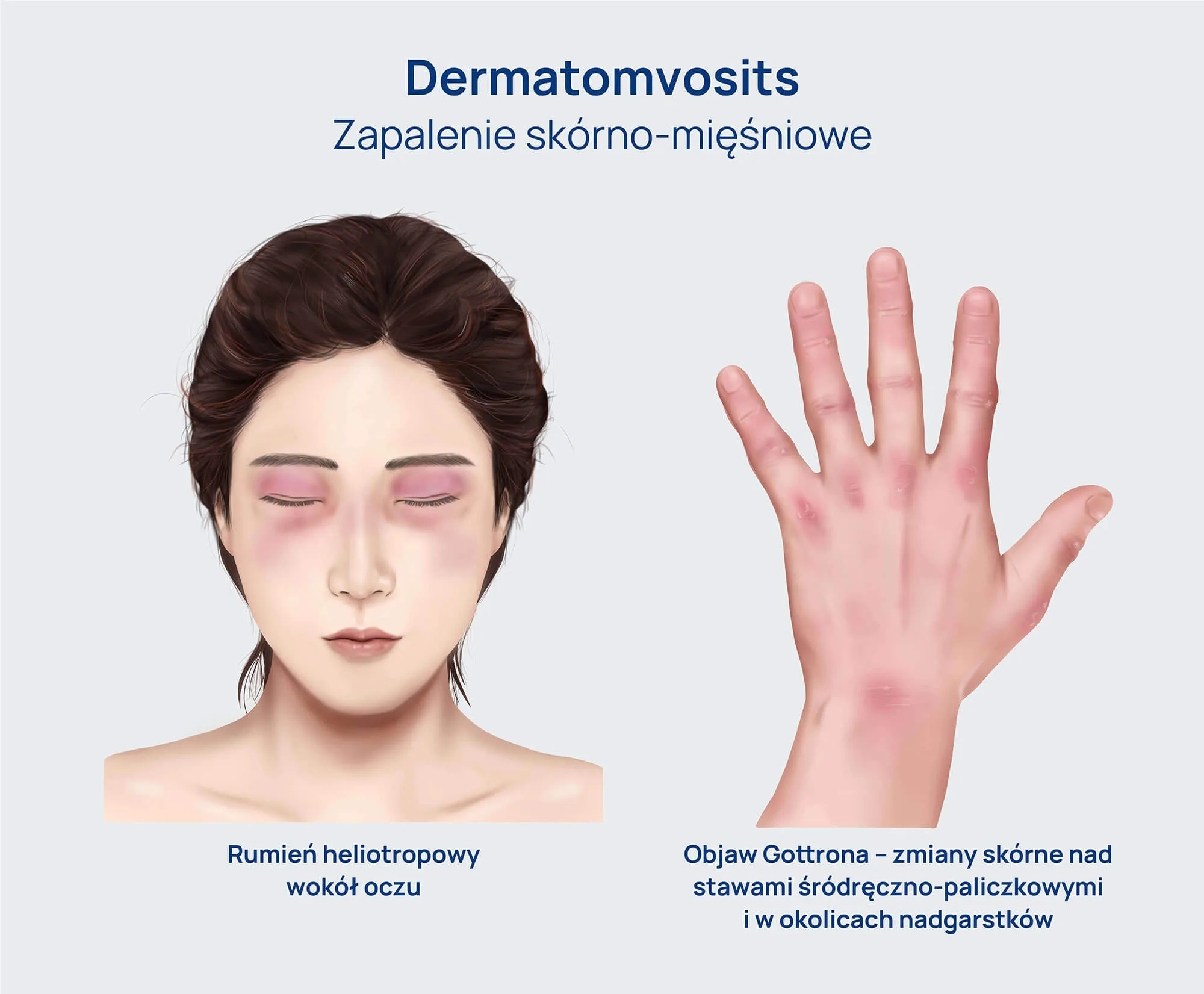
- Zapalenie skórno-mięśniowe (DM) – zwykle objawia się jako nagłe lub postępujące osłabienie mięśni proksymalnych, któremu towarzyszy charakterystyczna wysypka skórna. Typowe wysypki obejmują: rumień na szyi, plecach, ramionach, policzkach i twarzy oraz fioletowe przebarwienia powiek, często związane z obrzękiem okołogałkowym. Pacjenci zgłaszają trudności we wstawaniu z krzesła, wchodzeniu po schodach, podnoszeniu przedmiotów oraz czesaniu włosów. Choroba zazwyczaj nie jest „bolesna”, jednak w ostrym przebiegu i w przypadku obecności zwapnień podskórnych, ból może być znaczący. U niektórych pacjentów rozwijają się: duszność związana ze śródmiąższową chorobą płuc lub osłabieniem mięśni oddechowych, zaburzenia połykania, wynikające z zajęcia przełyku lub gardła, niewydolność serca lub arytmia z powodu zapalenia mięśnia sercowego, a także krwawienia z przewodu pokarmowego. Zapalenie skórno-mięśniowe może występować samodzielnie lub współistnieć z innymi zespołami.
- Zapalenie wielomięśniowe (PM) – objawia się zajęciem mięśni oraz narządów wewnętrznych, podobnie jak w przypadku zapalenia skórno-mięśniowego, ale bez wysypki. Zazwyczaj występuje u dorosłych, częściej u kobiet, powyżej 20. roku życia i, w przeciwieństwie do DM, rzadko dotyka dzieci. Typowo objawia się postępującym osłabieniem mięśni szyi oraz mięśni kończyn. Częstymi dolegliwościami są bóle mięśni i tkliwość. U jednej trzeciej pacjentówwystępują problemy z przełykaniem. Najczęstszymi pozamięśniowymi objawami są śródmiąższowa choroba płuc oraz zapalenie mięśnia sercowego.
- Wtrętowe zapalenie mięśni (IBM) – prowadzi do osłabienia i degeneracji mięśni w określonych obszarach ciała. Najczęściej dotkniętymi obszarami są nadgarstki i palce, przednia część ud oraz przednia część nóg poniżej kolan. W miarę jak mięśnie w tych obszarach stopniowo się osłabiają, mogą wystąpić następujące objawy: częste potykanie się i upadki, utrata stabilności kolan, utrata zdolności chodzenia lub sprawności dłoni, trudności w podnoszeniu przedniej części stopy (tzw. opadająca stopa). Objawy te zazwyczaj rozwijają się stopniowo, w ciągu kilku miesięcy, a czasami lat, i zawsze występują jednocześnie lub w równym stopniu po obu stronach ciała.
- Martwicze autoimmunologiczne zapalenie mięśni (NAM) – charakteryzuje się postępującym osłabieniem mięśni proksymalnych, głównie ramion i bioder, bez towarzyszącej wysypki skórnej. Osoby z NAM często mają objawy bólu mięśniowego (myalgia) oraz trudności w przełykaniu (dysfagia). Osłabienie mięśni w NAM rozwija się zazwyczaj szybciej i jest bardziej nasilone niż w PM.
Występujące u dzieci i młodzieży młodzieńcze zapalenie skórno-mięśniowe charakteryzuje się zapaleniem mięśni oraz specyficznymi zmianami skórnymi.Choroba tamoże prowadzić do osłabienia mięśni, bólu oraz zmęczenia, a w niektórych przypadkach także do zajęcia narządów wewnętrznych, co może zagrażać życiu.
Miopatie zapalne – diagnostyka przeciwciał
W celu postawienia odpowiedniej diagnozy, badania powinny obejmować dokładny wywiad lekarski, badanie fizykalne, rutynowe testy laboratoryjne (morfologia krwi, pełny panel metaboliczny, enzymy mięśniowe, hormon stymulujący tarczycę oraz inne ukierunkowane badania w razie potrzeby), badania serologiczne w kierunku specyficznych autoprzeciwciał, badania obrazowe, ocenę neurologiczną, badanie przewodnictwa nerwowego oraz biopsję mięśni. Należy rozważyć również wpływ czynników środowiskowych, niedawno przebyte infekcje, stosowane leki oraz suplementy diety.
Kryteria kliniczne nadal są używane do klasyfikacji choroby, jednakże identyfikacja autoprzeciwciał w surowicy pacjenta może pomóc zidentyfikować postać choroby z uwzględnieniem charakterystycznych objawów.
Oznaczanie autoprzeciwciał specyficznych dla miopatii zapalnych może pomóc w różnicowaniu fenotypu klinicznego i potwierdzeniu diagnozy. Obecnie MSA stanowią grupę ponad 20 autoprzeciwciał, z których każde może występować z różną częstością w konkretnej postaci klinicznej choroby. Przeciwciała te cechuje wysoka, sięgająca 100% specyficzność, co oznacza, że nie występują one raczej w innych stanach klinicznych ani u osób zdrowych.
W diagnostyce miopatii zapalnych zalecane jest stosowanie jak najszerszych badań panelowych w kierunku autoprzeciwciał. Im szerszy zakres badań, tym większa szansa na wykrycie specyficznych autoprzeciwciał, które mogą wskazać na konkretny typ miopatii zapalnej. Dzięki temu można precyzyjniej zdiagnozować chorobę, co pozwala na lepsze dobranie odpowiedniego leczenia. Szerokie panele zwiększają również szansę na wykrycie rzadkich wariantów choroby i innych współistniejących zaburzeń autoimmunologicznych. Profil Myositis (profil zapalenia mięśni) jest precyzyjnym narzędziem diagnostycznym, które pozwala na oznaczenie podczas jednego badania przeciwciał przeciwko 18 antygenom.
Miopatie zapalne – metody leczenia
Główne cele terapii miopatii zapalnych to przywrócenie siły mięśni, kontrola lub eliminacja zapalenia, ochrona innych organów przed uszkodzeniem i poprawa jakości życia chorego. Optymalne leczenie powinno mieć charakter wielodyscyplinarny, obejmujący neurologię, reumatologię, dermatologię, pulmonologię, terapię fizyczną i zajęciową oraz logopedię.Pierwszą linią leczenia u dorosłych z DM, PM i NAM jest zwykle wprowadzenie wysokich dawek kortykosteroidów. W wielu przypadkach konieczne jest również równoczesne rozpoczęcie leczenia immunosupresyjnego. Decyzja o wprowadzeniu drugiej linii leczenia zależy od stopnia osłabienia mięśni, początkowej reakcji na kortykosteroidy, ryzyka nawrotu choroby oraz zwiększonego ryzyka powikłań związanych z terapią sterydową (np. cukrzyca, osteoporoza).
Po zakończeniu leczenia inicjującego wprowadza się zwykle roczną terapię podtrzymującą, mając na celu stopniowe zmniejszanie dawki leku, aby zminimalizować ryzyko działań niepożądanych i jednocześnie kontrolować objawy choroby. Leczenie długoterminowe (faza późna) wprowadza się w celu utrzymywania remisji i zapobiegania nawrotom. Faza ta trwa od 1 roku do 3 lat, dąży się w niej do stosowania jak najmniejszych skutecznych dawek leków. Zaleca się również łączenie leczenia farmakologicznego z indywidualnie dobranymi ćwiczeniami.
Podsumowanie
Miopatie zapalne to grupa schorzeń o zróżnicowanych objawach i przyczynach. W ostatnich latach dostępne są nowe narzędzia do ich diagnostyki i leczenia. Wczesne rozpoznanie i skuteczne leczenie są kluczowe dla uzyskania najlepszych wyników i poprawy zdrowia pacjentów. Współczesne klasyfikacje miopatii zapalnych, rozwinięte na przestrzeni lat, poprawiły skuteczność diagnostyki dzięki ulepszonym metodom badania i obrazowania mięśni. Postępy w badaniach serologicznych (badania autoprzeciwciał) pozwalają na wczesne postawienie rozpoznania, dostarczają istotnych informacji o powiązaniach z innymi chorobami i wpływają na prognozy dotyczące leczenia.
Piśmiennictwo
- Malik A. et al., Idiopathic Inflammatory Myopathies: Clinical Approach and Management, Clinical Approach and Management. Front. Neurol, 2016; 7: 64, doi: 10.3389/fneur.2016.00064.
- Kucharz J.E. et al., Idiopatyczna miopatia zapalna (zapalenie wielomięśniowe, skórno-mięśniowe, martwicze autoimmunologiczne zapalenie mięśni i zapalenie mięśni z ciałkami wtrętowymi),Reumatologia, 2016;1: 45–50, doi: 10.5114/reum.2016.59998.
- https://neurologia-praktyczna.pl/a5496/Miopatie-zapalne.html/ [dostęp: 10.09.2024].
- Castro C. et al., Diagnosis and treatment of inflammatory myopathy: issues and management,Ther Adv Musculoskel Dis, 2012; 4; 2: 111–120, doi: 10.1177/ 1759720X11425092.
- Ashton C. et al., Idiopathic inflammatory myopathies: a review,Internal Medicine Journal 51, 2021; 845–852.