Wskaźnik HOMA jest narzędziem, które pozwala na orientacyjną ocenę insulinooporności oraz funkcji komórek beta trzustki odpowiedzialnych za produkcję insuliny. Dzięki prostocie i dostępności, wskaźnik ten stał się popularny zarówno w badaniach naukowych, jak i w diagnostyce klinicznej. W artykule wyjaśniamy, czym jest wskaźnik HOMA, jak się go oblicza, kiedy warto wykonać badanie oraz jak interpretować jego wyniki.
Spis treści:
- Wskaźnik HOMA – co to jest?
- Jak obliczyć wskaźnik HOMA?
- Indeks HOMA – kiedy zrobić badanie?
- Badanie HOMA – jak interpretować wynik?
Wskaźnik HOMA – co to jest?
Wskaźnik HOMA (Homeostasis Model Assessment) jest matematycznym modelem służącym do oceny insulinooporności oraz funkcji komórek beta trzustki. Insulinooporność to stan, w którym komórki organizmu stają się mniej wrażliwe na działanie insuliny, hormonu odpowiedzialnego między innymi za regulację poziomu glukozy we krwi. Jest to kluczowy czynnik sprzyjający rozwojowi cukrzycy typu 2 i zespołu metabolicznego.
Model HOMA opiera się na pomiarze stężenia glukozy i insuliny na czczo. Wskaźnik HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) jest najczęściej stosowanym wariantem tego modelu i służy do oceny stopnia insulinooporności. Wartość jest proporcjonalna do nasilenia przypadłości – wyższe wartości wskaźnika sugerują większy stopień insulinooporności.
Wskaźnik HOMA-B (Homeostasis Model Assessment of Beta-cell Function) z kolei pozwala ocenić funkcję komórek beta trzustki.
Jak obliczyć wskaźnik HOMA?
Obliczenie wskaźnika HOMA-IR jest stosunkowo proste i opiera się na następującym wzorze:
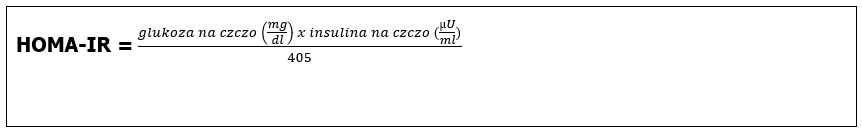
lub w przypadku używania jednostek SI:
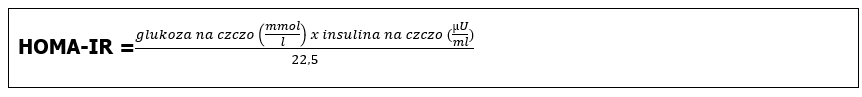
Wynik obliczenia wskaźnika HOMA-IR jest wartością bezwymiarową i interpretacja jego normy zależy przede wszystkim od wieku pacjenta:
- Dorośli: Wartość HOMA-IR powinna wynosić około 1,0 w warunkach fizjologicznych. Wartości powyżej 2,5 mogą wskazywać na insulinooporność.
- Dzieci i młodzież: na insulinooporność wskazują: :
- przed pokwitaniem: wartości > 2,67 u chłopców i > 2,22 u dziewcząt,
- podczas pokwitania: wartości > 5,22 u chłopców i > 3,82 u dziewcząt
Wskaźnik HOMA-B, służący do oceny funkcji komórek beta trzustki, można obliczyć według wzoru:

Wartości HOMA-B mogą pomóc w ocenie zdolności komórek beta do kompensowania insulinooporności przez zwiększoną produkcję insuliny.
Indeks HOMA – kiedy zrobić badanie?
Badanie wskaźnika HOMA-IR jest zalecane w:
- Diagnostyce insulinooporności: U osób z podejrzeniem insulinooporności, zwłaszcza tych z otyłością, nadciśnieniem tętniczym, dyslipidemią czy zespołem policystycznych jajników (PCOS), wskaźnik HOMA-IR może pomóc w potwierdzeniu rozpoznania.
- Monitorowanie pacjentów z cukrzycą typu 2: Wskaźnik HOMA-IR może być używany do monitorowania postępu choroby i skuteczności leczenia. Wysoki poziom HOMA-IR może wskazywać na potrzebę modyfikacji leczenia.
- Ocena ryzyka sercowo-naczyniowego: Ponieważ insulinooporność jest związana z wyższym ryzykiem chorób sercowo-naczyniowych, badanie HOMA-IR może być używane do oceny tego ryzyka, zwłaszcza u pacjentów z otyłością, nadciśnieniem czy dyslipidemią.
- Badania przesiewowe w populacjach ryzyka: U osób z wywiadem rodzinnym w kierunku cukrzycy typu 2 lub zespołu metabolicznego wskaźnik HOMA-IR może być używany do wczesnej identyfikacji insulinooporności.
- Ocena funkcji komórek beta: Wskaźnik HOMA-B jest używany w badaniach naukowych oraz w klinice do oceny zdolności komórek beta do produkcji insuliny, co może być pomocne w zrozumieniu patogenezy cukrzycy i ocenie progresji choroby.

Badanie HOMA – jak interpretować wynik?
Interpretacja wyników wskaźnika HOMA-IR i HOMA-B wymaga zrozumienia kontekstu klinicznego pacjenta. Wyniki powinny być interpretowane w połączeniu z innymi badaniami laboratoryjnymi oraz danymi klinicznymi.
HOMA-IR u dorosłych:
- Prawidłowy zakres: Wartość HOMA-IR między 1 a 2,5 jest uznawana za prawidłową.
- Podwyższony HOMA-IR: Wartości powyżej 2,5 mogą sugerować insulinooporność. Wartości powyżej 3,0 są często używane jako punkt odcięcia w diagnostyce insulinooporności, chociaż dokładne wartości progowe mogą się różnić w zależności od wytycznych i specyficznej populacji pacjentów.
- Bardzo wysoki HOMA-IR: Wyniki znacznie przekraczające normę mogą wskazywać na zaawansowaną insulinooporność, co zwiększa ryzyko rozwoju cukrzycy typu 2 i chorób sercowo-naczyniowych.
Wskaźnik HOMA jest cennym narzędziem w ocenie insulinooporności i funkcji komórek beta trzustki. Choć wskaźnik ten ma pewne ograniczenia, wynikające z założeń modelu oraz indywidualnych różnic między pacjentami, stanowi ważny element w diagnostyce i monitorowaniu zaburzeń metabolizmu glukozy. Jego zastosowanie może pomóc w wczesnym wykrywaniu insulinooporności i zapobieganiu rozwojowi poważnych chorób, takich jak cukrzyca typu 2 i choroby sercowo-naczyniowe. Warto jednak pamiętać, że interpretacja wyników HOMA powinna być zawsze dokonana w kontekście klinicznym i w połączeniu z innymi badaniami diagnostycznymi.
Opieka merytoryczna: lek. Katarzyna Banaszczyk
Bibliografia
- https://www.mp.pl/podrecznik/pediatria/chapter/B42.168.4.8.3.
- Reaven GM. What do we learn from measurements of HOMA-IR? Diabetologia. 2013 Aug;56(8):1867-8.
- Tahapary DL., Pratisthita LB., Fitri NA. et al. Challenges in the diagnosis of insulin resistance: Focusing on the role of HOMA-IR and Tryglyceride/glucose index. Diabetes Metab Syndr. 2022 Aug;16(8):102581.