Zespół nabytego niedoboru odporności (Acquired Immune Deficiency Syndrome, skr. AIDS) jest jedną z najbardziej znanych i wyniszczających chorób cywilizacyjnych, która od lat 80. XX wieku stanowi poważne wyzwanie dla globalnego zdrowia publicznego. Spowodowana przez wirus ludzkiego niedoboru odporności (HIV), choroba ta prowadzi do stopniowego niszczenia układu odpornościowego, co czyni organizm podatnym na infekcje i nowotwory. W ciągu ostatnich dekad naukowcy osiągnęli znaczące postępy w diagnostyce i leczeniu AIDS, jednak choroba nadal stanowi poważny problem zdrowotny, szczególnie w krajach rozwijających się. Dowiedz się dlaczego.
Spis treści:
- AIDS – co to za choroba?
- AIDS a HIV – jakie są różnice?
- Jak dochodzi do zakażenia wirusem HIV, powodującym chorobę AIDS?
- AIDS – objawy choroby
- AIDS – rozpoznanie i diagnostyka
- AIDS – leczenie
- AIDS – zapobieganie zakażeniom wirusem HIV
- AIDS – rokowania i długość życia
AIDS – co to za choroba?
AIDS jest zaawansowanym stadium zakażenia wirusem HIV, który atakuje i niszczy komórki układu odpornościowego, głównie limfocyty T CD4+. W miarę postępu choroby liczba tych komórek gwałtownie spada, co osłabia zdolność organizmu do walki z infekcjami i nowotworami. AIDS to nie choroba sama w sobie, ale zespół objawów wynikających z osłabienia odporności, co prowadzi do tzw. chorób wskaźnikowych, takich jak gruźlica, zapalenie płuc czy niektóre nowotwory (np. mięsak Kaposiego).
AIDS a HIV – jakie są różnice?
Wirus HIV i choroba AIDS często są używane zamiennie, jednak nie oznaczają tego samego. HIV (Human Immunodeficiency Virus) to wirus, który wywołuje infekcję. Po przedostaniu się do organizmu atakuje układ odpornościowy, a nieleczony może doprowadzić do rozwoju AIDS, co zazwyczaj zajmuje kilka lat. AIDS natomiast to końcowe stadium nieleczonego zakażenia HIV, w którym liczba limfocytów CD4+ spada poniżej 200 komórek/µl lub gdy u pacjenta rozwijają się choroby wskaźnikowe.
>> Chcesz dowiedzieć się więcej o wirusie HIV? Sprawdź nasz artykuł: Wszystko, co powinieneś wiedzieć o HIV
Jak dochodzi do zakażenia wirusem HIV, powodującym chorobę AIDS?
Zakażenie wirusem HIV dochodzi przez kontakt z płynami ustrojowymi osoby zakażonej. Główne drogi transmisji obejmują:
- Drogę płciową: Niezabezpieczone kontakty seksualne (w szczególności analne i waginalne) są najczęstszą przyczyną zakażenia HIV.
- Droga parenteralna: Zakażenie może nastąpić poprzez kontakt z zakażoną krwią, np. podczas transfuzji krwi, wspólnego używania igieł wśród osób zażywających narkotyki czy przy kontaktach z narzędziami medycznymi.
- Droga wertykalna: Wirus HIV może być przekazany przez łożysko a matki na dziecko, podczas porodu lub w okresie karmienia piersią.
Wirus HIV nie przenosi się poprzez codzienne kontakty, takie jak dotyk, dzielenie się jedzeniem czy korzystanie ze wspólnych toalet.
| Warto wiedzieć: Niektórzy ludzie w populacji mają delecję w genie CCR5 i są naturalnie odporni na zakażenie HIV. Gen CCR5 koduje receptor, który HIV wykorzystuje do wnikania wewnątrz limfocytów. Osoby z delecją tego genu nie mają funkcjonalnego receptora CCR5, co uniemożliwia wirusowi infekcję ich komórek. |
Aby dowiedzieć się więcej o chorobach przenoszonych drogą płciową oraz o tym, jak skutecznie się przed nimi chronić, zapoznaj się z poniższymi artykułami:
>> Choroby przenoszone drogą płciową
>> Rzeżączka – choroba przenoszona drogą płciową
AIDS – objawy choroby
Objawy AIDS różnią się w zależności od fazy infekcji i stopnia uszkodzenia układu odpornościowego. Zakażenie HIV przebiega w kilku etapach:
- Ostra infekcja HIV
W ciągu 2-4 tygodni od zakażenia może wystąpić tzw. serokonwersja – zespół grypopodobnych objawów, takich jak gorączka, bóle mięśni i stawów, bóle gardła, powiększenie węzłów chłonnych czy wysypka. W tym okresie wirus intensywnie namnaża się, a liczba limfocytów CD4+ gwałtownie spada.
- Bezobjawowe stadium przewlekłe
Po fazie ostrej organizm przechodzi w fazę bezobjawową, która może trwać od kilku do kilkunastu lat. W tym czasie wirus nadal namnaża się, ale objawy kliniczne mogą być minimalne lub nieobecne.
- Zaawansowane stadium HIV: AIDS
Kiedy liczba limfocytów CD4+ spada poniżej krytycznego poziomu, układ odpornościowy jest zbyt słaby, by chronić organizm przed infekcjami. To stadium charakteryzuje się ciężkimi zakażeniami oportunistycznymi, nowotworami oraz poważnym wyniszczeniem organizmu.
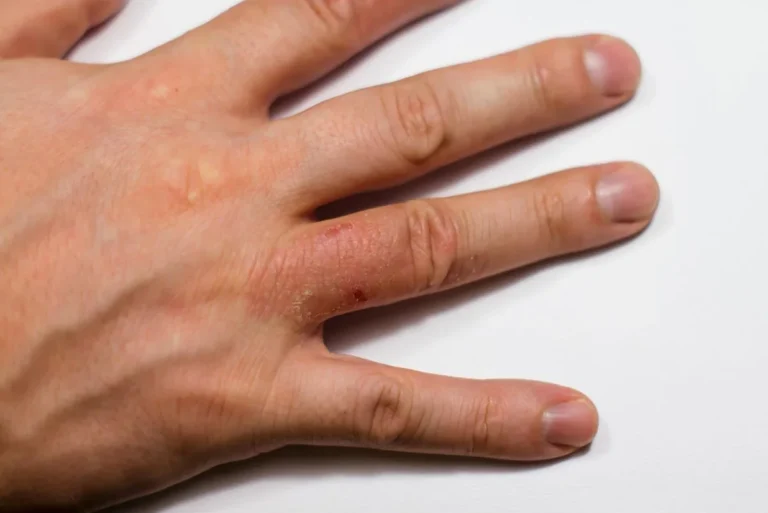
AIDS – objawy skórne
Jednym z charakterystycznych objawów AIDS są zmiany skórne. Do najczęstszych należą:
- Mięsak Kaposiego: To nowotwór wywołany przez wirusa HHV-8, który pojawia się w formie czerwonych, purpurowych lub brązowych plam na skórze, błonach śluzowych, a nawet w narządach wewnętrznych.
- Grzybicze i wirusowe infekcje skóry: Wśród pacjentów z AIDS częste są zmiany skórne spowodowane przez grzyby (np. kandydoza) oraz wirusy (np. brodawki wywołane przez wirusa HPV).
- Opryszczka: Pacjenci z zaawansowaną postacią HIV często doświadczają nawracających i długotrwałych zakażeń opryszczką.

AIDS – rozpoznanie i diagnostyka
Rozpoznanie AIDS opiera się na ocenie klinicznych objawów i wyników badań laboratoryjnych. Kluczowe kryteria obejmują:
- liczbę limfocytów T CD4+ poniżej 200 komórek/µl (wykorzystywane są także testy wirusologiczne, które mierzą ilość wirusa HIV we krwi (tzw. wiremia)),
- występowanie chorób wskaźnikowych (potwierdzanych niekiedy za pomocą obrazowania czy biopsji).
Rozpoznanie AIDS opiera się na różnych metodach diagnostycznych, w tym:
- ELISA (Enzyme-Linked Immunosorbent Assay): Test przesiewowy wykrywający przeciwciała przeciwko HIV w surowicy.
- Western Blot: Test potwierdzający obecność wirusa poprzez analizę specyficznych białek wirusowych.
- PCR (Polymerase Chain Reaction): Metoda detekcji materiału genetycznego HIV, umożliwiająca wczesną diagnozę oraz monitorowanie leczenia.
- Cytometria przepływowa: Technika oceny liczby i subpopulacji limfocytów T CD4+, istotna dla oceny stanu układu odpornościowego.
- Badania serologiczne: Dodatkowe testy wykrywające obecność przeciwciał i antygenów wirusa.
>> Sprawdź też: Kto i kiedy powinien wykonać test w kierunku zakażenia wirusem HIV?
AIDS – leczenie
Choć AIDS pozostaje chorobą nieuleczalną, nowoczesne terapie znacząco wydłużają życie pacjentów i poprawiają jego jakość. Podstawą leczenia HIV/AIDS jest terapia antyretrowirusowa (ART), która hamuje replikację wirusa i pozwala utrzymać liczbę limfocytów CD4+ na poziomie umożliwiającym prawidłowe funkcjonowanie układu odpornościowego. ART składa się z kombinacji kilku leków (zwykle co najmniej trzech) z różnych klas, co minimalizuje ryzyko rozwoju oporności wirusa.
| Czy wiesz, że: Chiński naukowiec – He Jiankui – wykorzystał technologię CRISPR-Cas9 do edytowania genów zarodków dwóch dziewczynek, które przyszły na świat. Celem edycji było usunięcie genu CCR5, który koduje receptor, przez który wirus HIV wnika do komórek. He starał się stworzyć dzieci, które byłyby odporne na zakażenie HIV. |
AIDS – zapobieganie zakażeniom wirusem HIV
Skuteczne zapobieganie zakażeniom HIV obejmuje edukację społeczeństwa na temat bezpiecznych zachowań seksualnych, w tym stosowania prezerwatyw, ograniczenia liczby partnerów seksualnych oraz regularnych badań na HIV. Ważnym elementem profilaktyki jest także:
- Profilaktyka przedekspozycyjna (PrEP): Stosowanie leków antyretrowirusowych przez osoby, które są narażone na zakażenie (np. partnerzy osób zakażonych).
- Profilaktyka poekspozycyjna (PEP): Podanie leków antyretrowirusowych po potencjalnym narażeniu na wirusa, np. po wypadkach zawodowych czy gwałtach.
>> To może Cię zainteresować: Zdrowie kobiety – diagnostyka mikrobiomu i infekcji intymnych
AIDS – rokowania i długość życia
Rokowania dla osób z HIV znacznie poprawiły się dzięki terapii antyretrowirusowej. Obecnie pacjenci, którzy regularnie stosują ART, mogą żyć niemal tak długo, jak osoby niezakażone. Nieleczone zakażenie HIV prowadzi jednak do rozwoju AIDS w ciągu około 10 lat od infekcji, a po rozwinięciu się pełnoobjawowego AIDS czas przeżycia wynosi zazwyczaj kilka lat, w zależności od dostępności leczenia i występowania zakażeń oportunistycznych.
AIDS wciąż stanowi wyzwanie, ale postęp w diagnostyce, leczeniu i profilaktyce znacząco poprawił perspektywy dla osób zakażonych wirusem HIV. Dzięki edukacji, łatwiejszemu dostępowi do testów oraz terapii antyretrowirusowej, możliwe jest zahamowanie rozwoju choroby i poprawa jakości życia pacjentów. Mimo tych postępów walka z HIV/AIDS nadal wymaga globalnych działań, zwłaszcza w krajach z ograniczonym dostępem do opieki zdrowotnej.
Bibliografia
- https://www.mp.pl/interna/chapter/B16.II.18.2 (dostęp: 14.10.2024).
- Gładysz A., Knysz B. Zakażenia HIV i AIDS – poradnik dla lekarzy. Continuo, 2014.
- Sahoo CK., Sahoo NK., Rao SRM. et al. A Review on prevention and treatment of aids. Pharm Pharmacol Int J. 2017;5(1):9-17.
- Sonawane RB., Barkade GD. Literature Review on Acquired Immunodeficiency Syndrome (AIDS). Sys Rev Pharm 2023; 14(4): 219-225.