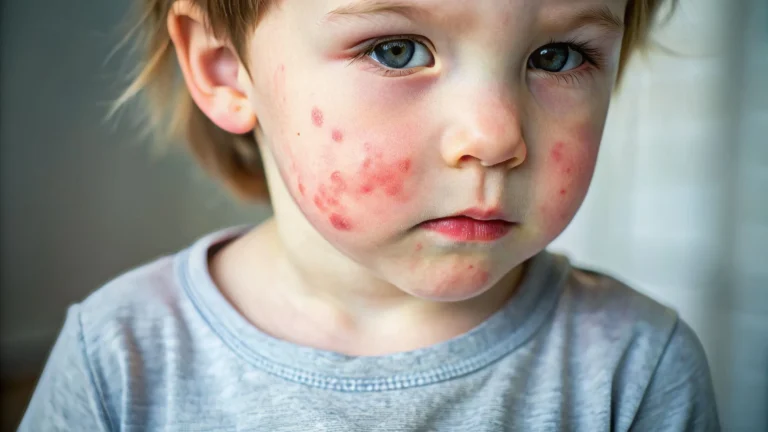
Liszaj płaski to stosunkowo częsta, zapalna choroba skóry, która może istotnie obniżać jakość życia pacjentów. Czym grozi nieleczony liszaj płaski? Jak wygląda liszaj płaski w jamie ustnej, a jak liszaj płaski sromu? Dowiedz się więcej o tej chorobie dermatologicznej.
Spis treści:
- Co to jest liszaj płaski?
- Liszaj płaski: przyczyny rozwoju choroby
- Objawy liszaja płaskiego: jak wygląda?
- Diagnostyka liszaja płaskiego
- Liszaj płaski: leczenie
Co to jest liszaj płaski?
Liszaj płaski to zapalna, przewlekła choroba skóry, która może zajmować zarówno skórę gładką, jak i owłosioną skórę głowy, błony śluzowe i paznokcie. Diagnostyka liszaja płaskiego nie zawsze jest prosta, ponieważ schorzenie to może występować w kilku odmianach, które różnią się od siebie obrazem klinicznym. Poza najczęstszym, klasycznym typem liszaja płaskiego, wyróżniamy takie odmiany tego schorzenia jak:
- hipertroficzna, nazywana też brodawkującą,
- barwnikowa,
- obrączkowata,
- zanikowa,
- linijna,
- odmiana zajmująca dłonie i podeszwy,
- pęcherzowa,
- pemfigoidowa.
>> Sprawdź: Białe plamki na paznokciach – co oznaczają i dlaczego powstają?
U kogo może wystąpić liszaj płaski?
Liszaj płaski może się rozwinąć w każdym wieku – zarówno u dzieci, jak i osób starszych. Dane statystyczne donoszą, że z liszajem płaskim zmaga się około 1-2% populacji. Choć uważa się, że choroba dotyka kobiety i mężczyzn z podobną częstością, to zmiany w obrębie błony śluzowej jamy ustnej pojawiają się znacznie częściej u płci żeńskiej. W niektórych przypadkach, szczególnie tych, które cechują się ciężkim przebiegiem, zauważono rodzinną predyspozycję do zachorowania.
Liszaj płaski: przyczyny rozwoju choroby
Mimo wielu badań naukowych, przyczyny pojawiania się liszaja płaskiego nadal nie zostały do końca poznane. Choroba ta związana jest z nieprawidłowościami dotyczącymi układu immunologicznego. Liszaj płaski jest powiązany przede wszystkim z limfocytami T, które przylegają do komórek naskórka, tworząc naciek zapalny, co predysponuje do pojawienia się charakterystycznych objawów skórnych. Zmiany liszajopodobne mogą być też wywoływane przez stosowanie niektórych leków.
Diagnozując liszaja płaskiego, należy mieć świadomość, że może on współwystępować z wieloma schorzeniami, do których zalicza się przede wszystkim:
- cukrzycę,
- zaburzenia lipidowe,
- autoimmunologiczne zapalenie tarczycy,
- łysienie plackowate,
- bielactwo,
- wrzodziejące zapalenie jelita grubego,
- toczeń rumieniowaty układowy,
- wirusowe zapalenia wątroby, przede wszystkim zapalenie typu C.
>> To może Cię zainteresować: Wirus HCV – podstępny zabójca

Objawy liszaja płaskiego: jak wygląda?
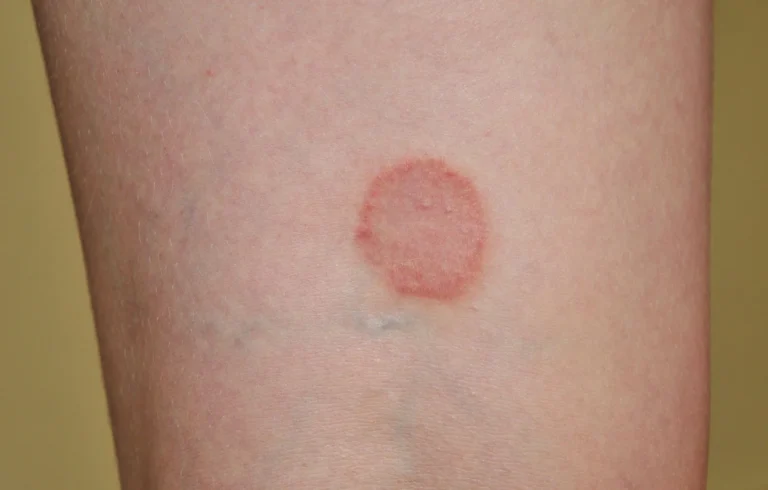
W klasycznej postaci liszaja płaskiego obserwuje się obecność na skórze zmian w postaci płaskich, lekko lśniących, wielobocznych grudek, które przyjmują kolor fioletowo-różowy. Zmiany mogą pojawić się w każdym obszarze ciała, ale najczęściej lokalizują się w okolicy:
- powierzchni zgięciowej przedramion,
- powierzchni grzbietowej rąk,
- przedniej powierzchni podudzi,
- krzyżowo-lędźwiowej,
- narządów płciowych.
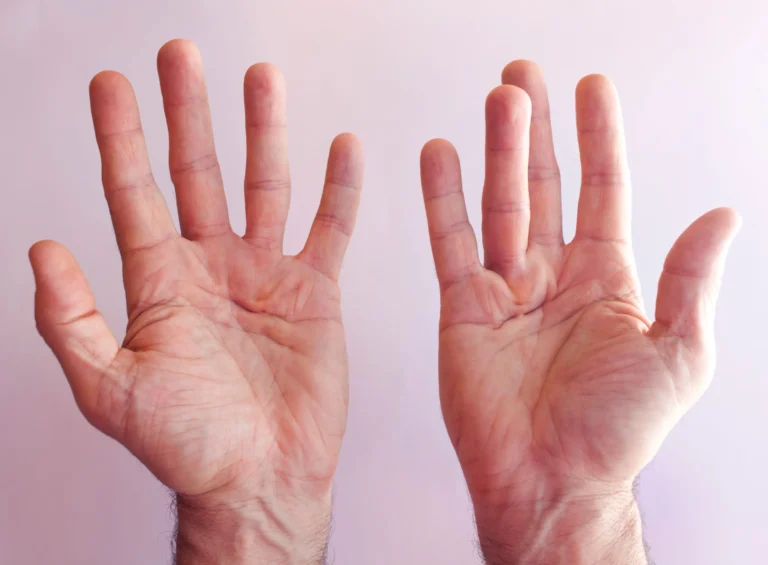
Zmiany skórne mogą się ze sobą zlewać. Pacjenci bardzo często zgłaszają również silny świąd, który skłania do drapania skóry. Często zajęte są również paznokcie, w obrębie których obserwujemy ścieńczenie płytki, podłużne bruzdowanie, oddzielanie się płytki paznokciowej, a także zmiany jej zabarwienia.
Objawy chorobowe mogą się pojawić także w obrębie owłosionej skóry głowy. Można wówczas zaobserwować zajęcie mieszków włosowych i łysienie (liszaj płaski mieszkowy). Zmiany przybierają postać łysienia bliznowaciejącego, w którego przebiegu obserwuje się nieodwracalną utratę włosów.
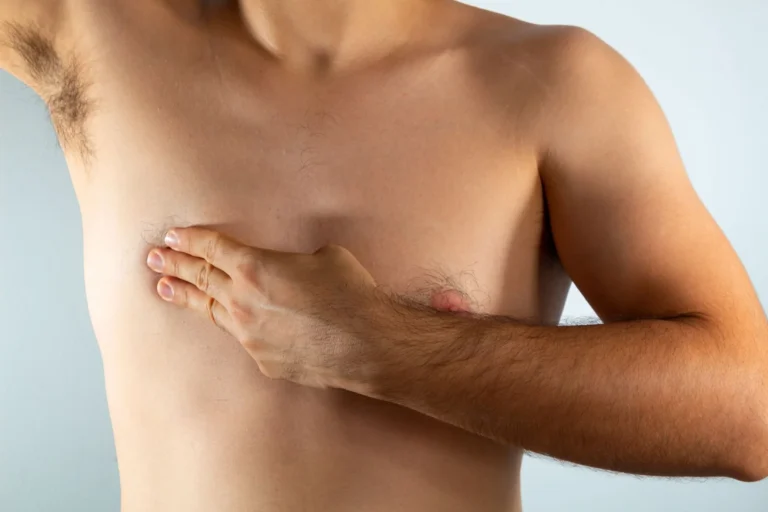
Objawy liszaja płaskiego narządów płciowych
Jedną z typowych lokalizacji dla liszaja płaskiego jest okolica płciowa. Zmianom w tym obszarze często towarzyszy obecność wykwitów w obrębie jamy ustnej. U kobiet liszaj płaski okolic płciowych pojawia się na wargach sromowych większych i mniejszych, a także w okolicy wzgórka łonowego, z kolei u mężczyzn najczęściej zajęta jest żołądź i trzon prącia.
Jak wyglądają zmiany w tej lokalizacji? Można zaobserwować między innymi obecność:
- zmian grudkowych o układzie obrączkowatym, bez tendencji do bliznowacenia,
- nadżerek wokół ujścia pochwy z towarzyszącym bliznowaceniem,
- przerostowych ognisk w okolicy krocza i odbytu.
Należy podkreślić, że wieloletnie, zaawansowane zmiany w przebiegu liszaja płaskiego narządów płciowych niosą ze sobą ryzyko nowotworzenia.
>> Przeczytaj także: Najczęstsze nowotwory u kobiet i mężczyzn
Objawy liszaja płaskiego jamy ustnej
Zmiany w obrębie jamy ustnej mogą występować nawet u 75% pacjentów z liszajem płaskim. Przyjmują one typowo postać symetrycznie układających się siatkowatych zbieleń, zlokalizowanych wzdłuż linii zgryzu. Obecne mogą być również bolesne nadżerki, a także zmiany zanikowe.
Diagnostyka liszaja płaskiego
Diagnostyka liszaja płaskiego opiera się w pierwszej linii na przeprowadzeniu dokładnego wywiadu chorobowego oraz badania przedmiotowego. Na potwierdzenie rozpoznania pozwala pobranie biopsji do badania histopatologicznego. Czasami wykonuje się również badanie immunopatologiczne, szczególnie w postaciach manifestujących się pęcherzami, w celu różnicowania liszaja płaskiego z chorobami pęcherzowymi.
Badania laboratoryjne przy liszaju płaskim
Jak już wspomniano, liszaj płaski może współwystępować z innymi schorzeniami przewlekłymi, w tym również infekcyjnymi. Z tego powodu warto zdecydować się na wykonanie niektórych badań laboratoryjnych, w tym na oznaczenie:
- przeciwciał anty-HCV oraz antygenu HbS (w celu wykrycia WZW),
- prób wątrobowych,
- glukozy na czczo,
- panelu tarczycowego (TSH, fT3, fT4),
- przeciwciał przeciwjądrowych ANA-1,
- lipidogramu,
- kalprotektyny w kale (przy obecności objawów z przewodu pokarmowego).

Badanie podmiotowe i przedmiotowe przy liszaju płaskim
W trakcie badania przedmiotowego bardzo pomocne może okazać się wykonanie dermatoskopii, a więc oglądania zmian skórnych w powiększeniu. Dermatoskopia może pomóc nam w postawieniu wstępnego rozpoznania, ponieważ obraz dermatoskopowy zmian skórnych w przebiegu omawianego schorzenia jest dość charakterystyczny. Mianowicie, w powiększeniu uwidocznieniu może ulec m.in. tak zwana siateczka Wickhama, a więc linijne zbielenia na powierzchni zmian skórnych.
Badania histopatologiczne przy liszaju płaskim
Badanie histopatologiczne pozwala na ostateczne potwierdzenie rozpoznania. W obrazie histopatologicznym wycinka skóry na pierwszy plan wysuwają się zmiany w obrębie naskórka, w tym pogrubienie warstwy ziarnistej oraz zwyrodnienie wodniczkowe warstwy podstawnej.
Liszaj płaski: leczenie
Rodzaj terapii zależy przede wszystkim od rozległości zmian skórnych. Przy niewielkim zajęciu skóry stosuje się leczenie miejscowe z wykorzystaniem glikosteroidów w kremie lub maści, a także inhibitorów kalcyneuryny. W bardziej zaawansowanych przypadkach konieczne jest leczenie ogólne. Stosuje się głównie sterydy, acytretynę, azatioprynę, a także metotreksat. W liszaju płaskim skóry gładkiej pomocna może okazać się również fototerapia.
Nieleczony liszaj płaski: skutki i następstwa
Liszaj płaski wymaga podjęcia odpowiedniego leczenia, ponieważ jego zaniechanie może wiązać się z pewnymi powikłaniami. Zalicza się do nich:
- bliznowacenie i powstanie rozległych przebarwień,
- możliwość transformacji nowotworowej w obrębie zmian (szczególnie zmiany na błonach śluzowych),
- obniżenie jakości życia związane z obecnością zmian skórnych i silnym świądem (zaburzenia nastroju, zaburzenia snu).
>> Sprawdź również: Jak wygląda świerzbiączka guzkowa?
Liszaj płaski to przewlekła choroba skóry, która może zajmować skórę, śluzówki i paznokcie. Diagnostyka polega na wykonaniu badania przedmiotowego, ale również histopatologicznego. Dużą rolę w identyfikacji schorzeń współistniejących odgrywają badania laboratoryjne. Jeżeli obecne są u nas objawy sugerujące liszaja płaskiego, to warto jak najszybciej umówić się na wizytę u dermatologa i rozpocząć odpowiednią diagnostykę i terapię.
Bibliografia
- L. Rudnicka i inni, Współczesna Dermatologia, Wydawnictwo PZWL, Warszawa 2022,
- L. Bolognia i inni, Fourth Edition Dermatologia, Medipage, Warszawa 2022,
- J. Maj i inni, Dermatologia w przypadkach, Termedia Wydawnictwo Medyczne, Poznań 2017.