Przedwczesna menopauza to stan, który dotyka około 1% kobiet przed ukończeniem 40. roku życia, wywierając istotny wpływ na ich zdrowie fizyczne i psychiczne. Oznacza wygasanie funkcji jajników znacznie wcześniej niż w typowej menopauzie. W artykule wyjaśnimy, czym jest przedwczesna menopauza, jakie są jej przyczyny i objawy oraz jak wygląda diagnostyka i proces leczenia. Poznasz również potencjalne skutki nieleczenia oraz możliwości związane z płodnością w tym stanie.
Spis treści:
- Czym jest menopauza?
- Przedwczesna menopauza: przyczyny
- Przedwczesna menopauza: objawy
- Diagnostyka przedwczesnej menopauzy
- Przedwczesna menopauza: leczenie
- Przedwczesna menopauza a ciąża. Czy możliwy jest powrót owulacji?
Czym jest menopauza?
Menopauza to naturalny proces, który występuje u większości kobiet w wieku od 45 do 55 lat. To moment, w którym jajniki przestają produkować komórki jajowe, a poziom hormonów, takich jak estrogeny i progesteron, znacznie się obniża. Konsekwencją jest ustanie cykli menstruacyjnych.
>> Więcej informacji znajdziesz w artykule: Menopauza – ważny okres w życiu kobiety
Przedwczesna menopauza różni się od naturalnej menopauzy wiekiem, w którym występuje, oraz większym ryzykiem poważnych konsekwencji zdrowotnych.
Przedwczesna menopauza: przyczyny
Przedwczesna menopauza, nazywana także przedwczesnym wygasaniem czynności jajników (ang. POI – Premature Ovarian Insufficiency), ma wiele potencjalnych przyczyn. Należą do nich:
- czynniki genetyczne – mutacje genetyczne, np. w genie FMR1 (związanym z zespołem łamliwego chromosomu X), mogą prowadzić do przedwczesnej menopauzy.
- choroby autoimmunologiczne – układ odpornościowy atakuje jajniki, powodując ich niewydolność.
- leczenie onkologiczne – radioterapia i chemioterapia mogą uszkadzać tkanki jajników, prowadząc do ich niewydolności.
- czynniki środowiskowe – toksyny, stres oksydacyjny, palenie papierosów czy ekspozycja na chemikalia wpływają na funkcje jajników.
- infekcje wirusowe – niektóre wirusy, jak wirus świnki, mogą prowadzić do zapalenia jajników i ich uszkodzenia.
>> Przeczytaj też: Brak miesiączki – możliwe przyczyny braku okresu. Jakie badania przeprowadzić?
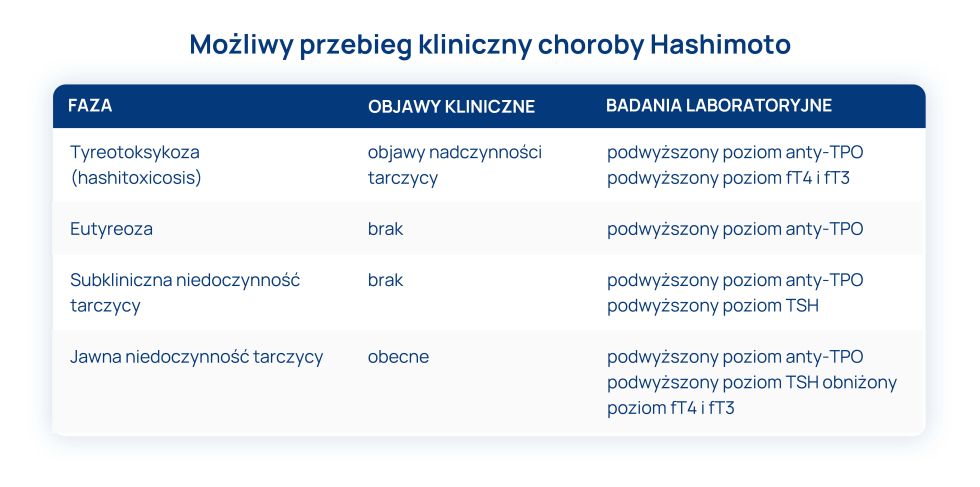
Przedwczesna menopauza a Hashimoto i inne choroby autoimmunologiczne
Choroby autoimmunologiczne, takie jak choroba Hashimoto czy choroba Addisona, niekiedy mogą współwystępować z przedwczesną menopauzą. Układ odpornościowy atakujący własne tkanki, w tym jajniki, może odgrywać rolę w rozwoju tego stanu. Mechanizmy tej zależności są jednak złożone i nie zawsze jednoznacznie wskazują na bezpośrednią przyczynę przedwczesnego wygasania czynności jajników. W takich przypadkach zaleca się szczegółową diagnostykę i indywidualne podejście terapeutyczne.
Zaburzenia hormonalne a przedwczesna menopauza
Hormony odgrywają kluczową rolę w regulacji cyklu menstruacyjnego i funkcjonowania jajników. Zaburzenia hormonalne, takie jak wysokie stężenia FSH, LH przy niskich stężeniach estradiolu, mogą wskazywać na przedwczesne wygasanie czynności jajników. Monitorowanie poziomów hormonów i regularne konsultacje z lekarzem mogą pomóc w wczesnym wykryciu problemu.
>> To może Cię zainteresować: LH hormon – hormon luteinizujący, luteotropina. Czym jest i za co odpowiada? Kiedy wykonuje się badanie?
Przedwczesna menopauza: objawy
Objawy przedwczesnej menopauzy są podobne do tych, które towarzyszą typowej menopauzie, ale pojawiają się znacznie wcześniej. Do najczęstszych objawów należą:
- nieregularne cykle menstruacyjne lub ich całkowity brak,
- uderzenia gorąca i nocne poty,
- suchość pochwy,
- spadek libido,
- zmienność nastroju, drażliwość,
- problemy z pamięcią i koncentracją,
- bóle stawów i mięśni.
Kondycja skóry przy wczesnej menopauzie
Spadek poziomu estrogenów wpływa negatywnie na skórę, powodując jej wysuszenie i utratę elastyczności. Wczesne starzenie się skóry jest jednym z widocznych objawów przedwczesnej menopauzy. Kobiety mogą zauważyć także problemy z regeneracją skóry i większą podatność na podrażnienia.
>> Sprawdź także: Równowaga hormonalna u kobiet
Diagnostyka przedwczesnej menopauzy
Diagnostyka przedwczesnej menopauzy wymaga współpracy z lekarzem ginekologiem, endokrynologiem i wykonania odpowiednich badań. Kluczowe etapy to:
- dokładny wywiad lekarski dotyczący objawów, historii chorób i stylu życia,
- badanie fizykalne, w tym badanie ginekologiczne,
- badania laboratoryjne w celu oceny poziomu hormonów, takich jak FSH, LH, estradiol i AMH. Dodatkowo warto wykluczyć inne schorzenia, takie jak zespół policystycznych jajników (PCOS), hiperprolaktynemia czy choroby tarczycy.
>> Zobacz też: Zespół policystycznych jajników (PCOS) – przyczyny, objawy, diagnostyka, leczenie
Przedwczesna menopauza: jakie badania laboratoryjne wykonać?
W diagnostyce przedwczesnej menopauzy pomocne są następujące badania:
- FSH (hormon folikulotropowy) – jego podwyższony poziom wskazuje na niewydolność jajników.
- estradiol – niski poziom estradiolu jest charakterystyczny dla menopauzy.
- AMH (anty-Müllerowski hormon) – ocenia rezerwę jajnikową, a jego niski poziom sugeruje przedwczesną menopauzę.
- badania w kierunku chorób autoimmunologicznych – takie jak obecność przeciwciał przeciwtarczycowych (anty-TPO) czy przeciwciał przeciw korze nadnerczy.

Przedwczesna menopauza: leczenie
Leczenie przedwczesnej menopauzy ma na celu złagodzenie objawów, poprawę jakości życia i zapobieganie długoterminowym skutkom zdrowotnym. Obejmuje:
- hormonalną terapię zastępczą (HTZ) – pozwala uzupełnić niedobory estrogenów i progesteronu, redukując objawy menopauzy.
- terapie wspomagające płodność – w niektórych przypadkach możliwe jest zastosowanie technik wspomaganego rozrodu, np. in vitro.
- suplementację diety – zwłaszcza preparatów wapnia i witaminy D, aby wspierać zdrowie kości.
- zalecenia dotyczące stylu życia – aktywność fizyczna, zdrowa dieta i unikanie używek mają kluczowe znaczenie.
>> To może Cię zainteresować: Badania laboratoryjne u pacjentek przyjmujących hormony (antykoncepcję hormonalną, HTZ)
Nieleczona przedwczesna menopauza: skutki
Niepodjęcie leczenia przedwczesnej menopauzy może prowadzić do poważnych skutków, takich jak:
- osteoporoza i złamania kości,
- choroby sercowo-naczyniowe,
- zaburzenia psychiczne, w tym depresja i zaburzenia lękowe,
- nieodwracalna utrata płodności.
>> Przeczytaj również: Diagnostyka zaburzeń gospodarki wapniowej w organizmie
Przedwczesna menopauza a ciąża. Czy możliwy jest powrót owulacji?
Przedwczesna menopauza, czyli wygasanie czynności jajników, często prowadzi do trwałej niezdolności do naturalnego zajścia w ciążę. Niemniej w niektórych przypadkach, szczególnie gdy występuje niestabilność funkcji jajników, mogą zdarzyć się spontaniczne owulacje. Dotyczy to jednak niewielkiej liczby kobiet.
Dla pacjentek, które pragną zajść w ciążę, dostępne są metody wspomaganego rozrodu, takie jak zapłodnienie in vitro z wykorzystaniem własnych komórek jajowych (o ile ich rezerwa jajnikowa jest wystarczająca) lub komórek dawczyni.
Przedwczesna menopauza to wyzwanie, które wymaga uwagi i odpowiedniej opieki medycznej. Wczesne rozpoznanie i leczenie mogą znacznie poprawić jakość życia oraz zmniejszyć ryzyko poważnych powikłań. Jeśli zauważasz objawy mogące świadczyć o przedwczesnej menopauzie, skontaktuj się z lekarzem i wykonaj odpowiednie badania. Dbaj o swoje zdrowie – to najlepsza inwestycja w przyszłość.
Bibliografia
- Ishizuka B. Current Understanding of the Etiology, Symptomatology, and Treatment Options in Premature Ovarian Insufficiency (POI). Front Endocrinol (Lausanne). 2021
- Li M i wsp. The global prevalence of premature ovarian insufficiency: a systematic review and meta-analysis. Climacteric. 2023
- Fenton AJ. Premature ovarian insufficiency: Pathogenesis and management. J Midlife Health. 2015
- Kirshenbaum M i wsp. Premature ovarian insufficiency (POI) and autoimmunity-an update appraisal. J Assist Reprod Genet. 2019