Tkanka tłuszczowa w organizmie człowieka pełni kilka ważnych funkcji: ochronną, izolacyjną, energetyczną i endokrynną. Jakie mamy rodzaj tkanki tłuszczowej? Czym się różnią? Jakie pełnią funkcje? Dlaczego powinniśmy dbać o to, aby mieć więcej brązowej tkanki tłuszczowej? Dowiesz się z artykułu.
Spis treści:
- Tkanka tłuszczowa – rodzaje
- Tkanka tłuszczowa biała – rola, budowa, umiejscowienie
- Tkanka tłuszczowa brunatna – rola, budowa, umiejscowienie
- PODSUMOWANIE
Tkanka tłuszczowa – rodzaje
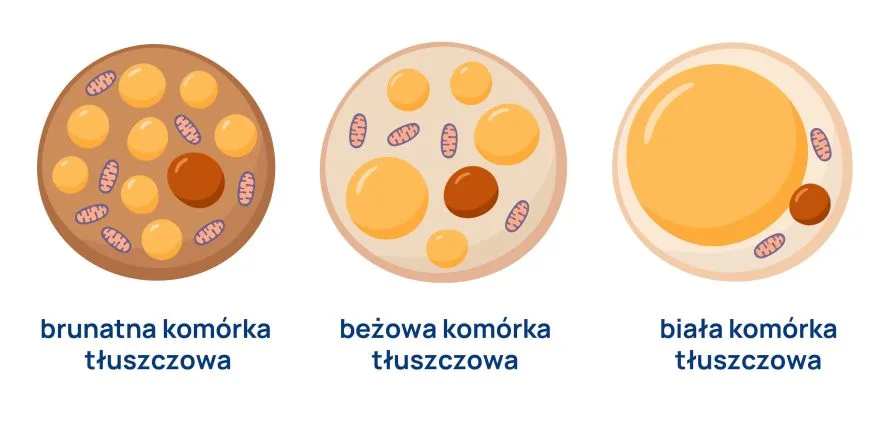
W organizmie człowieka stwierdza się obecność trzech rodzajów tkanki tłuszczowej. Są to:
- biała tkanka tłuszczowa (WAT, ang. white adipose tissue)
- brunatna (brązowa) tkanka tłuszczowa (BAT, ang. brown adipose tissue)
- różowa tkanka tłuszczowa (PAT, ang. pink adipose tissue)
Oprócz wymienionych rodzajów adiopocytów, wyróżnia się także komórki beżowe, które są postacią pośrednią pomiędzy białą i brunatną tkanką tłuszczową.
Każdy rodzaj tkanki ma różne role do spełnienia, jednak każda z nich spełnia funkcje endokrynne – wydzielają substancje o charakterze hormonów.

Tkanka tłuszczowa biała – rola, budowa, umiejscowienie
Biała tkanka tłuszczowa jest dominującą tkanką tłuszczową naszego organizmu. Jest przede wszystkim magazynem energii, ale odpowiada również za amortyzację i izolację – chroniąc poszczególne narządy przez urazami i uszkodzeniami mechanicznymi.
Białą tkankę tłuszczową cechuje plastyczność (wielkość jej komórek może wynosić od 20 do 200 μm), a tłuszcz może stanowić aż 90% objętości jej komórek, spychając cytoplazmę, jądro i organella komórkowe na peryferia. Oznacza to, iż w sytuacji nadmiernego dostarczania energii z pokarmem powstaje nadwaga, a następnie otyłość.
Biała tkanka tłuszczowa zbudowana jest z:
- tłuszczu, który stanowi 60-90% – w tym aż 90-99% to trójglicerydy, poza tym kwasy tłuszczowe, cholesterol, fosfolipidy;
- wody, stanowiącej 5-30%;
- białek.
Oprócz kumulowania energii, ten rodzaj tkanki tłuszczowej jest odpowiedzialny za wydzielanie wielu aktywnych substancji, wpływających na procesy łaknienia i sytości, na działanie insuliny, metabolizm glukozy i tłuszczów, regulujących ciśnienie tętnicze krwi, krzepliwość krwi, itp.
Do substancji wydzielanych przez adipocyty zaliczamy m.in:
- adipokiny – hormony tkanki tłuszczowej, w wśród nich: leptynę, adiponektynę, rezystynę, omentynę;
- hormony steroidowe: estron, estradiol, testosteron, hormon wzrostu;
- cytokiny i czynniki wzrostu: TNF-α– czynnik martwicy nowotworów, IL-6;
- czynniki naczynioaktywne: angiotensynogen/angiotensyna II, przedsionkowy peptyd natriuretyczny, prostaglandynę I2;
- modulatory metaboliczne: apolipoproteina E, kwasy tłuszczowe, prostaglandynę E2.
Pełna lista substancji wydzielanych przez adipocyty jest bardzo długa i dobrze pokazuje, dlaczego leczenie otyłości jest tak trudnym procesem.
Tkanka tłuszczowa biała – umiejscowienie
Tkanka tłuszczowa buduje tzw. depozyty. W przypadku białej tkanki tłuszczowej są to:
- depozyty podskórne – gromadzone w okolicach brzucha i okolicy pośladkowo udowej;
- depozyty trzewne (brzuszne) – gromadzone w otrzewnej, krezce oraz pozaotrzewnowo;
- depozyty międzynarządowe – gromadzone okołowątrobowo i międzymięśniowo.
Rozmieszczenie białej tkanki tłuszczowej jest bardzo ważnym wskaźnikiem i czynnikiem ryzyka wystąpienia zaburzeń metabolicznych.
Jeśli jej nadmiar gromadzi się w okolicy jamy brzusznej, mamy do czynienia z otyłością centralną (typu jabłko), natomiast jeśli rozmieszczony jest w dolnej części ciała (biodra, pośladki) występuje otyłość gynoidalna (typu gruszka).
Otyłość centralna wiąże się w ryzykiem występowanie chorób sercowo-naczyniowych, cukrzycy i innych zaburzeń metabolicznych, wisceralna tkanka tłuszczowa charakteryzuje się bowiem dużo większą aktywnością metaboliczną.
Aktywność białej tkanki tłuszczowej
Zdolność tkanki tłuszczowej do lipolizy (wytwarzania kwasów tłuszczowych) podlega wielu regulacjom:
- hormonalnej,
- nerwowej,
- czynników fizjologicznych (wiek, stan odżywienia, stres, aktywność fizyczna).
Hormony i substancje wpływające na aktywność tkanki tłuszczowej możemy podzielić na dwie grupy:
- Hormony i czynniki stymulujące lipolizę (w dużym uproszczeniu są to hormony wpływające na przyrost masy ciała):
- katecholaminy – działają poprzez aktywację układu współczulnego – receptorów β-adrenergicznych (zwłaszcza receptora β3, występującego głównie w tkance tłuszczowej brzusznej)
- TSH i hormony tarczycy
- hormon wzrostu – który potęguje i wspiera efekty działania katecholamin
- glukagon
- parathormon
- kortyzol – również wspiera efekty działania katecholamin, ale reguluje również ekspresję β-receptorów
- testosteron – szczególnie u mężczyzn w otyłości typu brzusznego i zespole PCOS
- żeńskie hormony płciowe
- Hormony i czynniki hamujące lipolizę to m.in.:
- insulina – hormon o najsilniejszym działaniu antylipolitycznym, działający anabolicznie
- katecholaminy – przez hamowanie α2- receptora
- IGF-1
- adenozyna.
>> Zobacz też: Układ hormonalny człowieka. Budowa, funkcje, hormony
Tkanka tłuszczowa brunatna – rola, budowa, umiejscowienie
Tkanka tłuszczowa brązowa, określana również jako brunatna tkanka tłuszczowa, jest odpowiedzialna przede wszystkim za utrzymywanie stałej temperatury ciała oraz wykorzystywanie nadmiaru energii dostarczanej z pokarmem.
Ciekawostką jest fakt, iż ten rodzaj tkanki tłuszczowej występuje tylko u ssaków. Barwę brunatną adipocytom tej tkanki tłuszczowej nadają cytochromy umiejscowione w bardzo licznie występujących mitochondriach.
Wielkość skupisk BAT zależy od kilku czynników. Należą do nich:
- płeć,
- wiek,
- pora roku,
- zawartość białej tkanki tłuszczowej,
- poziom aktywności fizycznej.
Tkanka tłuszczowa brunatna – umiejscowienie
Komórki brązowej tkanki tłuszczowej pojawiają się pod koniec ciąży – około siódmego miesiąca. U noworodka jest to tkanka już w pełni rozwinięta, umiejscowiona głównie w górnych partiach ciała, w okolicach:
- tętnic szyjnych,
- tętnic podobojczykowych,
- śródpiersia,
- dołu pachowego,
- między łopatkami.
Umiejscowienie brązowej tkanki tłuszczowej w ciele dorosłego człowieka jest podobne jak u noworodków. Najwięcej komórek brązowych leżu w okolicy nadobojczykowej i na karku. Uważa się, że to właśnie brunatna tkanka tłuszczowa odpowiada za powiększenie depozytów tłuszczu w okolicach karku u pacjentów z zespołem Cushinga.
Występowanie komórek brązowych notuje się również w śródpiersiu (w okolicy serca i aorty), wzdłuż rdzenia kręgowego, mniej podprzeponowo i w okolicach nadnerczy.
Tkanka tłuszczowa brunatna – budowa
Komórki tkanki tłuszczowej brązowej mają wielkość 20-40 μm (nawet 10 razy mniej niż komórki białe). Charakterystyczną ich cechą są liczne, bogate w cytochromy mitochondria. Tłuszcz w komórkach magazynowany jest w postaci wielu pęcherzyków, jądro komórki położone jest centralnie.
Ten rodzaj tkanki tłuszczowej charakteryzuje się bogatym unerwieniem i unaczynieniem.
Ważnym składnikiem brązowych komórek tłuszczowych jest białko nazywane termogeniną. Jego podstawową funkcją jest rozpraszanie i wydatkowanie energii cieplnej, kosztem wytwarzania i jej kumulowania w postaci ATP.
Brunatna tkanka tłuszczowa a wytwarzanie ciepła
Wytwarzanie i przenoszenie ciepła do tkanek odbywa się dzięki pośrednictwu układu sympatycznego (współczulnego). Stymulacja receptorów β2 i β3 adrenergicznych pobudza adipocyty do produkcji termogeniny i powoduje rozszerzenie docierających do nich naczyń krwionośnych. Wytworzone w komórkach ciepło pobierane jest następnie przez krew i transportowane do tkanek ciała.
Receptory β-adrenergiczne u człowieka rozmieszczone są w wielu tkankach i narządach całego ciała. Natomiast receptor β3-adrenergiczny w przeważającej części występuje w brunatnej tkance tłuszczowej brunatnej. niewielka aktywność notowana jest w pęcherzyku żółciowym, przewodzie pokarmowym i lewym przedsionku serca.
Aktywacja syntezy termogeniny u człowieka ma miejsce, gdy temperatura otoczenia spada poniżej 20-22°C, dzięki czemu krew może zachować prawidłową temperaturę, a ciepło może być rozprowadzane po całym organizmie.
Badania wskazują, iż długotrwała ekspozycja na zimno może aktywować BAT i zwiększać jej objętość, co obserwuje się u osób pracujących na wolnym powietrzu. Upośledzenie produkcji termogeniny obserwuje się w stanie otyłości. Modyfikacja brązowych komórek tłuszczowych zachodzi również pod wpływem deficytu kalorycznego – brunatne adipocyty kurczą się i zatrzymują tylko część energii wydatkowanej na termogenezę, dlatego osoby na dietach skarżą się na dyskomfort cieplny.
Tkanka tłuszczowa brunatna – jak zwiększyć jej objętość
Brunatna tkanka tłuszczowa jest sprzymierzeńcem człowieka, dlatego powinniśmy zadbać o jej optymalny poziom, aby nasze ciało mogło utrzymywać komfort cieplny.
Ilość brązowych komórek tłuszczowych zwiększa się pod wpływem:
- ekspozycji na zimno (zimne prysznice, obniżenie temperatury powietrza w pomieszczeniu),
- aktywności fizycznej,
- odpowiedniej diety (z optymalną zawartością żelaza – brunatna tkanka tłuszczowa jest bogata w żelazo).
Przebywanie w pomieszczeniach, w których panuje wysoka temperatura, nie sprzyja aktywności tej tkanki tłuszczowej. W przegrzanych pomieszczeniach komórki brązowe mogą zamieniać się komórki białe.
>> Przeczytaj też: Otyłość i jej zapobieganie – profilaktyka otyłości pierwotnej i wtórnej
PODSUMOWANIE
Adipocyty białe i brązowe to komórki tej samej tkanki, różniące się jednak budową, funkcją i wpływem na organizm człowieka. Warto wiedzieć, dlaczego tak się dzieje, jakie są konsekwencje ich działania i dlaczego należy dbać optymalny poziom zarówno tkanki białej, jak i brunatnej.
PIŚMIENNICTWO
- Murawska-Ciałowicz E., Tkanka tłuszczowa – charakterystyka morfologiczna i biochemiczna różnych depozytów, Postepy Hig Med Dosw (online), 2017; 71: 466-484 e-ISSN 1732-2693
- Buczkowska M, Buczkowski K, Głogowska-Gruszka A, Duda S, Dyaczyński M, Nowak P. Tkanka tłuszczowa – budowa i funkcje, ze szczególnym uwzględnieniem charakterystyki wybranych adipokin i ich wpływu na organizm. Med Og Nauk Zdr. 2019;25(3):162-169. doi:10.26444/monz/110429.