W dzisiejszych czasach dużo pisze się o otyłości, która jest wielkim problemem zdrowotnym współczesnego człowieka, stan który obecnie uznawany jest za jednostkę chorobową. Na przeciwnym biegunie otyłości jest niedożywienie, stan również ujęty w klasyfikacji ICD-10 i uznawany za chorobę.
Czym jest niedożywienie, jakie są jego przyczyny, jak się je rozpoznaje, jakie badania są pomocne w diagnostyce niedożywienia, jakie są objawy niedożywienia i jakie mogą być jego konsekwencje? O tym wszystkim jest artykuł.
Spis treści:
- Co to jest niedożywienie?
- Objawy niedożywienia
- Przyczyny niedożywienia
- Diagnostyka niedożywienia
- Niedożywienie – badania laboratoryjne
- Leczenie niedożywienia
- Niedożywienie – podsumowanie
Co to jest niedożywienie?
Niedożywienie jest odrębną jednostką chorobową, ujętą w klasyfikacji ICD-10 jak jedno z zaburzeń wydzielania wewnętrznego, stanu odżywienia i przemian metabolicznych – E40-E46.
Niedożywienie jest następstwem niewystarczającej podaży energii i składników odżywczych.
W przypadku tego stanu chorobowego możemy wyróżnić m.in.
- niedożywienie typu kwashiorkor,
- wyniszczenie z niedożywienia – marasmus,
- wyniszczenie białkowo-energetyczne – malnutritio.
Osobną jednostką chorobową jest zespół kacheksja/anoreksja nowotworowa (w ICD10 kod R41).
Objawy niedożywienia
W następstwie niedożywienia rozwijają się takie objawy, jak:
- zmniejszenie masy ciała,
- osłabienie mięśni,
- upośledzenie odporności, wzrost częstotliwości infekcji,
- sucha i blada skóra, wypadające włosy, zaburzenia gojenia się ran,
- obniżona temperatura ciała,
- obrzęki – w niedożywieniu typu kwashiorkor.
Efektem niedożywienia są również zaburzenia funkcjonowania:
- układu trawienia – osłabienie perystaltyki jelit, zaburzenia trawienia i wchłaniania
- układu sercowo-naczyniowego – bradykardia (zmniejszenie częstotliwości akcji serca), słabsza kurczliwość mięśnia sercowego,
- układu oddechowego – osłabienie i zanik mięśni oddechowych pogarszają warunki wentylacji w płucach, w wyniki czego pojawia się hipoksja – niedotlenienie organizmu i stany zapalne płuc,
- układu kostnego – osteoporoza.
U osób z zespołem kacheksja/anoreksja nowotworowa jednym z pierwszych objawów jest jadłowstręt o różnym stopniu nasilenia. Mogą to być zaburzenia smaku i powonienia, uczucie szybkiego nasycania się po jedzeniu, mdłości. U pacjentów z tym zespołem obserwuje się również astenię – przewlekłe zmęczenie.
>> Przeczytaj też: Ciągłe zmęczenie – problem XXI wieku. Czy to może być objaw choroby?
Przyczyny niedożywienia
Przyczyną niedożywienia są niedobory pokarmowe (białka i składników odżywczych w diecie). Mogą być następstwem:
- długotrwałego głodzenia,
- urazów,
- operacji,
- żywienia pozajelitowego,
- zespołów złego wchłaniania,
- przewlekłych chorób zakaźnych,
- chorób nowotworowych.
Niedożywienie jest poważnym problemem u pacjentów szpitalnych. Badania wskazują, iż około 35-55% osób przyjmowanych do szpitala jest niedożywionych, a 20% cierpi na ciężkie niedożywienie, wymagające natychmiastowego leczenia.
Z kolei u pacjentów z chorobą nowotworową niedożywienie występuje u ponad 75% osób.
Diagnostyka niedożywienia
Jak napisano wyżej, niedożywienie jest bardzo poważnym problemem pacjentów hospitalizowanych, dlatego przy przyjmowaniu do szpitala obowiązuje badanie przesiewowe, które ma wykryć osoby zagrożone tym stanem. Ocena stanu odżywienia dokonywana jest przy pomocy specjalnie do tego celu opracowanych skal (np. Nutritional Risk Screening 2002 – NRS 2020 lub Subjective Global Assessment – SGA).
Jeśli badanie przesiewowe wykaże, iż pacjent jest w grupie ryzyka niedożywienia, przeprowadza się pogłębioną ocenę stanu odżywienia, która polega na przeprowadzeniu wywiadu żywieniowego, badań antropometrycznych i badań laboratoryjnych.
- Wywiad żywieniowy dotyczy zmian w częstotliwości i ilości spożywanych posiłków, nawyków dietetycznych, występowania alergii i nietolerancji pokarmowych, dolegliwości ze strony przewodu pokarmowego oraz przyjmowanych leków – niektóre farmaceutyki wpływają na apetyt. Wywiad obejmuje również sytuację społeczną badanej osoby – złe warunki socjalne mogą sprzyjać niedożywieniu oraz pytanie o utratę masy ciała.
- Badania antropometryczne to przede wszystkim ocena BMI. Ponadto wykorzystuje się pomiar grubości fałdu skórnego nad mięśniem trójgłowym ramienia niedominującego. Grubość tego fałdu odzwierciedla zasoby tłuszczu w ustroju – ponad połowa tłuszczu zgromadzona jest w tkance podskórnej, zmniejszenie jej grubości odpowiada obniżeniu ilości tłuszczu i rezerwy energetycznej. Norma dla mężczyzn wynosi 12,6-11,3 mm, dla kobiet 16,5-14,9 mm.
U osób dorosłych niedożywienie można rozpoznać, jeśli spełnione jest przynajmniej jedno z poniższych kryteriów:
- BMI < 18,5 kg/m² (ryzykiem niedożywienia obarczony jest pacjent z BMI < 20,5 kg/m²)
- Niezamierzona utrata masy ciała > 10% (niezależnie od czasu) lub >5% w ciągu trzech miesięcy jeśli BMI < 20 kg/m² u pacjenta młodszego niż 70 lat lub BMI < 22 kg/m² u osób powyżej 70 r.ż.
- Niezamierzona utrata masy ciała > 10% (niezależnie od czasu) lub >5% w ciągu trzech miesięcy jeśli beztłuszczowa masa ciała <15 kg/m² u kobiet i <17 kg/m² u mężczyzn.
Niedożywienie – badania laboratoryjne
Laboratoryjne markery niedożywienia to markery białkowe oraz liczba leukocytów.
Białkowe markery niedożywienia to:
- Albumina – niestety ograniczeniem tego wskaźnika jest długi okres półtrwania, wynoszący 20 dni, co oznacza, iż zmiany jej stężenia we krwi nie odzwierciedlają aktualnego statusu żywieniowego, który może zmieniać się dosyć szybko. Niezależnie od tego uznaje się, iż stężenie albuminy niższe niż 3,5 g/dl świadczy o niedożywieniu, niższe niż 2,1 g/dl wskazuje na ciężkie niedożywienie.
- Transferyna – jej okres półtrwania wynosi ok. 10 dni, dlatego lepiej obrazuje aktualny status żywieniowy niż albumina. Jednak ograniczeniem transferyny w tym przypadku jest fakt, iż na jej stężenie wpływa również niedobór żelaza – jest to białko transportujące żelazo w osoczu krwi – i inne czynniki związane z żywieniem.
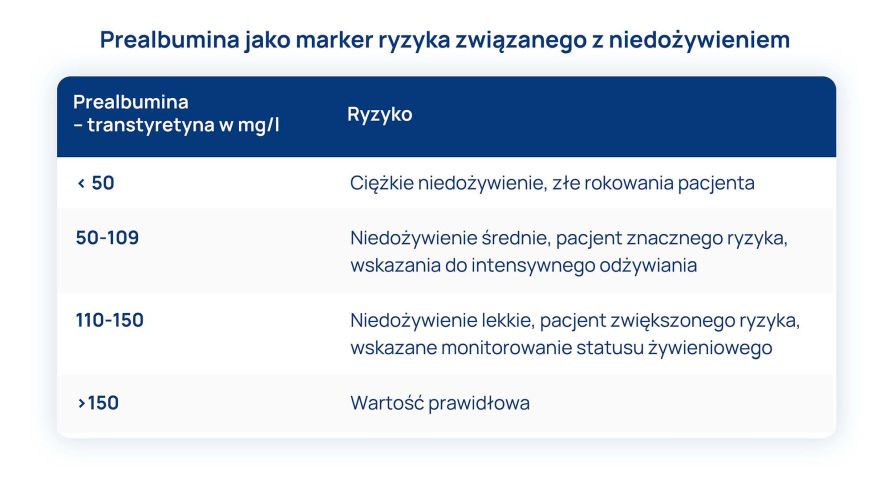
- Prealbumina (transtyretyna) – jest czulszym markerem niedożywienia, ponieważ – dzięki zawartości dużego odsetka aminokwasów egzogennych – jej okres półtrwania wynosi 2 dni. Dlatego stężenie tego parametru dobrze odzwierciedla stopień odżywienia oraz koreluje z rokowaniem. Wzrost poziomu prealbuminy obserwuje się u pacjentów z niedożywieniem po zaspokojeniu 65% potrzeb białkowo-energetycznych i widoczny jest po około tygodniu.

Liczba leukocytów
W stanie niedożywienia obniżona jest odporność, dlatego liczba limfocytów jest markerem statusu immunologicznego.
Całkowita liczba limfocytów w zależności od stanu niedożywienia – interpretacja.
| Stan odżywienia | CAŁKOWITA LICZBA LIMFOCYTÓW w 1 mm3 krwi |
| Prawidłowy | > 1500 |
| Niedożywienie lekkie | 1200–1499 |
| Niedożywienie umiarkowane | 800–1199 |
| Niedożywienie ciężkie | < 800 |
>> Przeczytaj też: Jak wzmocnić układ immunologiczny u dorosłych i dzieci?
Leczenie niedożywienia
Leczenie niedożywienia jest terapią łączącą wiele czynników. Jego najważniejszym elementem jest zapewnienie prawidłowej podaży składników odżywczych. Leczenie żywieniowe prowadzone jest w zależności od stanu chorego i może obejmować:
- dietę doustną (z poradnictwem dietetycznym i ewentualną suplementacją),
- żywienie sztuczne – dojelitowe lub pozajelitowe.
Dieta doustna – jeśli pacjent może ją otrzymywać – oparta jest na zbilansowanych lekkostrawnych posiłkach, o kaloryczności ok. 25-30 kcal/kg masy ciała.
Część pacjentów wymaga jednak ograniczeń w postaci diety bezlaktozowej, niskotłuszczowej, lub ograniczenia podaży błonnika. Chorzy z biegunką mogą odnieść korzyści z diety:
- BRAT (mało dojrzałe banany, biały ryż, pieczone jabłka, pszenne tosty)
- FODMAP.
Wskazania do konkretnej diety oraz jej prowadzenie muszą pozostawać pod kontrolą dietetyka. Stosowanie niezbilansowanych diet (np. ketogenicznej, bezglutenowej) może pogorszyć stan odżywienia pacjenta.
U niektórych pacjentów wymagana jest stymulacja apetytu.
W zależności od stanu pacjenta i przyczyny niedożywienia leczenie może być uzupełnianie niezbędnymi elementami, które są częścią indywidualnej terapii.
>> Przeczytaj też: Brak apetytu, brak łaknienia – czym jest, polecane żywienie

Niedożywienie – podsumowanie
Niedożywienie to stan często spotykany, zwłaszcza u pacjentów szpitalnych. Niedożywienie niesie za sobą poważne konsekwencje w postaci wzrostu powikłań, dłuższego pobytu w szpitalu, dłuższy okres rekonwalescencji i zwiększoną śmiertelność. Dlatego w przypadku tych pacjentów ważne jest jak najwcześniejsze postawienie rozpoznania i odpowiednie ich leczenie.
Bibliografia
- Ostrowska J., Jeznach-Steinhagen A.: Niedożywienie szpitalne. Metody oceny stanu odżywienia. Forum Medycyny Rodzinnej 2017; 11(2): 54–6. (dostęp 24.01.2025)
- Kłęk S., Kapała A.: Nutritional treatment. Oncol. Clin. Pract. 2018; 14. DOI: 10.5603/OCP.2018.0028. (dostęp 24.01.2025)
- Fizia K., Gętek M., Czech N., Muc-Wierzgoń M., Nowakowska-Zajdel E., Metody oceny stanu odżywienia u chorych na nowotwory, Pielęgniarstwo Polskie 2013, 2 (48), 105–110. (dostęp 24.01.2025)
- Dembińska-Kieć A, Naskalski J., Solnica B., Diagnostyka laboratoryjna z elementami biochemii klinicznej. Podręcznik dla studentów medycyny. wyd. IV, Wrocław 2018, 119. (dostęp 24.01.2025)
5. https://mediately.co/pl/icd?chapterCode=E00-E90&setCode=E40-E46&classificationCode=E41#active. (dostęp 24.01.2025)