Neutropenia oznacza zbyt niski poziom neutrofili we krwi. Neutrofile, określane również jako granulocyty obojętnochłonne, to rodzaj białych krwinek – leukocytów, biorących udział w budowaniu odporności człowieka.
Artykuł omawia przyczyny neutropenii, jej objawy, diagnostykę i postępowanie z pacjentem. Zachęcamy do przeczytania.
Więcej o tym, czym są neutrofile w artykule: Neutrofile (neutrocyty) – czym są? O czym świadczy podwyższony i obniżony poziom?
Spis treści:
- Neutrofile – budowa i rola w organizmie. Granulocyty segmentowe
- Neutrofile – wartości prawidłowe. Czym jest neutropenia?
- Neutropenia u dzieci i niemowląt
- Neutropenia – przyczyny
- Diagnostyka neutropenii
- Neutropenia – objawy
- Czy neutropenia jest groźna?
- Leczenie neutropenii. Czy neutropenia jest wyleczalna?
- Neutropenia – podsumowanie
Neutrofile – budowa i rola w organizmie. Granulocyty segmentowe
Neutrocyty to najliczniejsza wśród krwinek białych grupa komórek. Stanowi ponad 50%-55% krążących we krwi leukocytów. Dojrzały neutrofil ma charakterystyczny wygląd, jego jądro składa się z 2-5 płatów, dlatego bywa nazywany neutrofilem segmentowanym lub granulocytem segmentowym. Neutrofil niedojrzały natomiast ma jądro pałeczkowate – tego rodzaju granulocyty równie mogą być obecne w krwiobiegu.
Neutrofile są częścią mechanizmu odporności nieswoistej (wrodzonej), stanowiąc pierwszą linię obrony komórkowej przed różnymi patogenami. Granulocyty obojętnochłonne funkcjonują jako tzw. komórki żerne. Ich funkcja dokładnie odpowiada nazwie – neutrofile mają za zadanie pochłanianie (fagocytozę) patogenów lub ich fragmentów, biorą również udział w procesach zapalnych i alergicznych.
>> Przeczytaj też: Leukocyty w moczu – co oznaczają, jakie są normy i wskazania do badania?
Neutrofile – wartości prawidłowe. Czym jest neutropenia?
Badanie liczby neutrofili jest częścią morfologii krwi, prawidłową ich liczbę określają granice 1 500 – 8 000/μl. Dokładne wartości mogą różnić się nieznacznie w zależności od laboratorium, dlatego interpretację zawsze należy odnosić do norm podanych na wyniku.
Drugim parametrem określającym ilość tych krwinek – również widocznym w morfologii – jest % jaki stanowią neutrofile w całej grupie leukocytów.
Neutropenia jest zaburzeniem dosyć często stwierdzanym w badaniu morfologii. Oznacza obniżenie liczby granulocytów obojętnochłonnych poniżej 1500/μl. Zmniejszenie liczby neutrocytów poniżej 500/μl określane jest jako agranulocytoza. Powyższe wartości odnoszą się do osób dorosłych.
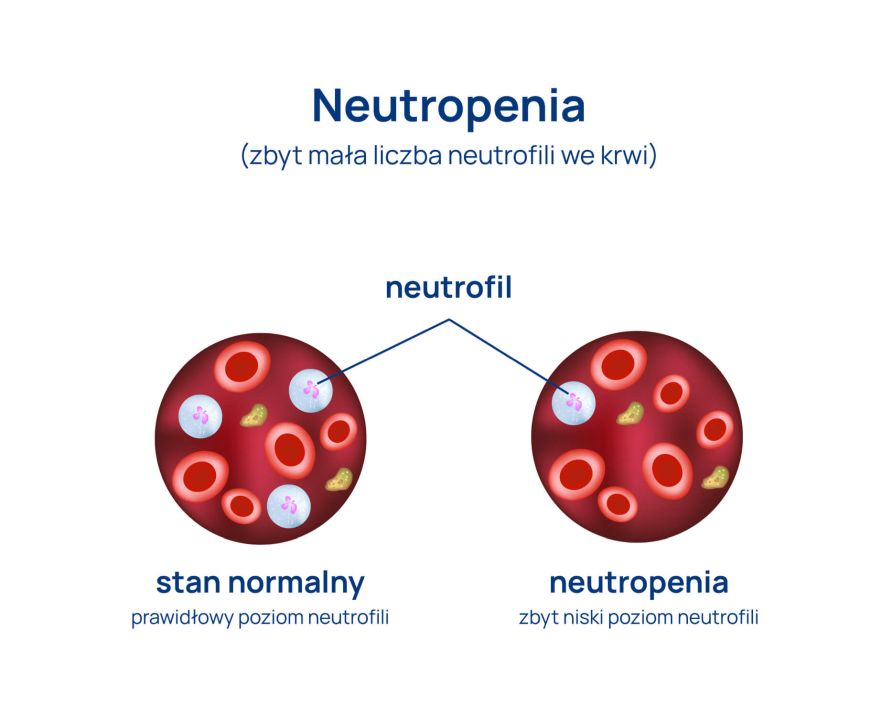
Neutropenia jest zaburzeniem, które może nie mieć znaczenia klinicznego. Może również być objawem poważnych chorób hematologicznych. Agranulocytoza natomiast jest poważnym osłabieniem odporności, predysponuje do wystąpienia infekcji bakteryjnych lub grzybiczych, ich następstwem może być nawet zagrażająca życiu sepsa.

Neutropenia u dzieci i niemowląt
Obniżony poziom neutrofili u dzieci rozpoznaje się na podstawie innych kryteriów niż u osób dorosłych – normy granulocytów obojętnochłonnych zmieniają się w zależności od wieku.
Rozpoznanie neutropenii u dzieci:
- noworodki (w 1 dobie) <<6000/μl,
- niemowlęta w 1 r.ż. <1000/μl,
- dzieci 1-8 r.ż. <1500 μl,
- dzieci powyżej 8 r.ż. <1800/μl.
Neutropenia – przyczyny
Neutropenia nie jest chorobą, lecz objawem, którego przyczynę należy wyjaśnić.
Przyczyny neutropenii możemy podzielić na:
- wrodzone,
- nabyte.
Neutropenia nabyta oznacza obniżony poziom neutrofili występujący w przebiegu różnych chorób lub będący skutkiem działania leków. Neutropenie nabyte są najczęstszą postacią tego zaburzenia.
Neutrofilia wrodzona to poziom neutrofili poniżej normy związany z mutacjami pewnych genów.
Przyczyny neutropenii nabytej
Neutropenia w infekcjach
- Niski poziom neutrofili może być spowodowany infekcjami. Mogą to być zakażenia różnego pochodzenia.
- Zakażenia wirusowe: ospa wietrzna, świnka, różyczka, grypa, RSV, opryszczka – neutropenia rozwija się zazwyczaj w pierwszych dniach choroby, trwa 3-7 dni i nie jest groźna dla zdrowia pacjenta. Dłużej trwająca neutropenia może być spowodowana wirusowymi zakażeniami przewlekłymi: cytomegalią (CMV), EBV, HIV, wirusowym zapaleniem wątroby typu B lub C.
- Zakażenia bakteryjne: bruceloza, dur brzuszny, gruźlica, zakażenie Mycoplasma.
- Neutropenia występuje także w malarii.
Obniżony poziom neutrofili może występować w przebiegu sepsy, jest wówczas złym czynnikiem rokowniczym.


Neutropenia polekowa
Zbyt niski poziom neutrocytów może wystąpić na skutek zażywania niektórych leków. Należą do nich:
- antybiotyki: penicyliny, cefalosporyny,
- trimetoprim-sulfametoksazol (Biseptol),
- niesterydowe leki przeciwzapalne: ibuprofen,
- paracetamol, metamizol (Pyralgina),
- klozapina – lek przeciwpsychotyczny,
- karbamazepina – lek przeciwpadaczkowy,
- tiamazol – lek stosowany w nadczynności tarczycy,
- sulfasalazyna.
Obniżony poziom neutrocytów powodowany zażywaniem leków może wystąpić na początku terapii, ale może mieć również miejsce później. Dlatego pacjent przyjmujący leki mogące skutkować neutropenią w przypadku wystąpienia infekcji przebiegającej z gorączką powinien udać się jak najszybciej do lekarza w celu wykonania badań krwi w kierunku agranulocytozy i zweryfikowania diagnozy.
Neutropenia po chemioterapii
Chemioterapia jest czynnikiem ryzyka wystąpienia obniżonego poziomu neutrocytów. Zaburzenia w liczbie neutrofili mogą mieć różny stopień nasilenia. Najczęściej w czasie chemioterapii występuje neutropenia łagodna, która nie daje żadnych objawów klinicznych.
Rzadziej występuje ciężka neutropenia, z zagrażającą życiu gorączkę neutropeniczną – u pacjentów w trakcie chemioterapii może ona się pojawić przy liczbie neutrocytów ok. 1000/μl.
Neutropenia autoimmunologiczna
Przyczyną tej postaci neutropenii są choroby autoimmunologiczne, zbyt niski poziom granulocytów obojętnochłonnych może być pierwszym objawem choroby. Badania wskazują, iż blisko 50% pacjentów z SLE ma neutropenię, która jednak nie wywołuje objawów klinicznych.
Obniżony poziom granulocytów obojętnochłonnych może być też objawem tocznia.
Jedną z chorób autoimmunologicznych występujących z neutropenią jest choroba Felty, dla której charakterystyczna jest triada objawów:
- RZS,
- splenomegalia (powiększenie śledziony),
- obniżony poziom neutrofili.
Neutropenia autoimmunologiczna przebiega również pod postacią neutropenii idiopatycznej, która częściej występuje u dorosłych kobiet. Diagnostyka tej postaci obniżonego poziomi neutrofili polega m.in. na:
- wykonywaniu testu aglutynacji granulocytów (GAT),
- oraz testu immunofluorescencyjnego (GIFT).
Neutropenia w chorobach hematologicznych
Neutrofile poniżej normy stwierdza się w szeregu chorób hematologicznych. Należą do nich:
- białaczki – przewlekła białaczka limfocytowa, białaczka włochatokomórkowa, ostre białaczki
- zespoły mielodysplastyczne,
- anemia aplastyczna,
- nocna napadowa hemoglobinuria,
- przerzuty guzów litych do szpiku kostnego.
>> Przeczytaj także: Białaczka (leukemia, rak krwi) – objawy, rodzaje, diagnostyka i leczenie
Neutropenia niedoborowa
Do rzadkich przyczyn neutropenii należą niedobory kwasu foliowego (witaminy B9), witaminy B12 lub miedzi.
>> Przeczytaj też: Jak diagnozować wczesny niedobór witaminy B12?
Przyczyny neutropenii wrodzonej
- Łagodna rodzinna neutropenia – liczba neutrofili nie spada poniżej 1000/μl, pacjenci nie są zagrożenie poważnymi infekcjami.
- Ciężka wrodzona neutropenia – u około połowy chorych związana jest z mutacją genu ELANE, polega na zahamowaniu wytwarzania neutrofili w szpiku kostnym.
- Cykliczna neutropenia – również związana z mutacją genu ELANE, charakteryzuje się nawracającymi epizodami neutropenii co 2-5 tygodni, zwykle co 21 dni. Sama neutropenia trwa 3-6 dni.
- Neutropenia związana z wadami wrodzonymi – diagnozowana jest we wczesnym dzieciństwie.
- Neutropenia etniczna – prawdopodobnie związana z mutacją genu DARC, nie ma znaczenia klinicznego. Dotyczy osób z korzeniami z Afryki lub Bliskiego Wschodu, ciekawostką jest, iż mutacja genu DARC (Duffy-Ag receptors for chemokines) – fenotyp Duffy ujemny chroni krwinki czerwone przed Plasmodium vivax, patogenem wywołującym malarię.
Oprócz wymienionych postaci neutropenii wrodzonej pojawiają się inne choroby dziedziczne, w których stwierdza się niski poziom neutrocytów. Dlatego w rodzinach, w których występują wrodzone postacie neutropenii, powinno przeprowadzać się konsultacje i badania genetyczne.
Diagnostyka neutropenii
Neutropenię stwierdza się, wykonując badanie morfologii krwi. Kluczowe znaczenie ma pogłębiona diagnostyka problemu i znalezienie przyczyny jego przyczyny.
Niezwykle ważne jest również rozpoznanie pacjentów, którzy wymagają natychmiastowej pomocy.
Pilnej interwencji wymaga pacjent:
- z gorączką neutropeniczną, czyli temperaturą ≥38,5°C, utrzymującą się przez ponad 1 h,
- oraz liczbą neutrofilów <500/μl.
Neutropenia 1000–1500/μl nie jest zaburzeniem obciążonym zwiększonym ryzykiem infekcji, ale oczywiście wymaga poszukiwania jej przyczyn. Pacjent powinien wówczas wykonać trzykrotnie morfologię, w odstępach jednomiesięcznych.
Jeśli liczba granulocytów obojętnochłonnych nie spada i nie występują objawy infekcji, uznaje się, iż jest to wariant normy dla danej osoby. Liczba neutrocytów poniżej 1000/μl zawsze jest wskazaniem do pogłębionej diagnostyki, nawet jeśli pacjent nie prezentuje objawów zakażenia.
Pacjenci z neutropenią – poza morfologią – wymagają badań funkcji wątroby i nerek oraz diagnostyki w kierunku zakażenia wirusem HIV, ewentualnie WZW B lub C. Pozostałe badania zależą od obrazu klinicznego choroby i mogą obejmować:
- biopsję szpiku,
- oznaczenie przeciwciał przeciwneutrofilowych, ANA, ACPA,
- czynnika reumatoidalnego.
Pacjent może wymagać również badania poziomu witaminy B12 i kwasu foliowego.
W przypadkach neutropenii wrodzonej rekomendowana jest konsultacja i diagnostyka genetyczna.

Neutropenia – objawy
Neutrofile odgrywają ważną rolę w utrzymaniu odporności organizmu. Dlatego objawem neutropenii są nawracające infekcje bakteryjne lub wirusowe. Mogą to być:
- zapalenie zatok – zwłaszcza z ropną wydzieliną z nosa i gorączką,
- zapalenie płuc,
- zapalenia ucha środkowego,
- zapalenie jamy ustnej – owrzodzenia, afty – usytuowane w całej jamie ustnej, także na podniebieniu i języku, mogą prowadzić do utraty uzębienia,
- zakażenia skóry i tkanek miękkich.
W przebiegu neutropenii może wystąpić również sepsa.
Czy neutropenia jest groźna?
Powikłania neutropenii zależą tego:
- jak głębokie jest obniżenie poziomu neutrofili,
- jaka jest jej przyczyna,
- czy pacjent ma choroby współistniejące.
Jeśli mamy do czynienia z agranulocytozą – czyli zmniejszeniem liczby neutrocytów poniżej 500/μl – jej konsekwencją najczęściej jest uogólniona infekcja, u co 10 pacjenta może wystąpić sepsa.
Rokowanie jest gorsze u pacjentów:
- z nowotworami, zwłaszcza jeśli dają objawy kliniczne,
- z POChP – przewlekłą obturacyjną chorobą płuc,
- w wieku > 60 lat.
Neutropenia w przebiegu większości chorób wirusowych jest zaburzeniem, które ma tendencję do samoograniczania – czyli mija wraz z powrotem pacjenta do zdrowia po infekcji.
Leczenie neutropenii. Czy neutropenia jest wyleczalna?
Neutropenia jest objawem, dlatego postępowanie i ewentualne leczenie należy skorelować z przyczyną zaburzenia.
W przypadku infekcji nie jest konieczne żadne dodatkowe działanie, należy leczyć chorobę podstawową i dbać o dobrostan pacjenta (odpowiednie nawodnienie i odżywianie).
Jeśli przyczyną obniżonych neutrofili jest choroba autoimmunologiczna, np. RZS, leczenie jest prowadzone przez lekarza reumatologa.
Jeśli źródłem problemu jest wirusowe zapalenie wątroby lub zakażenie wirusem HIV pacjent trafi do lekarza chorób zakaźnych.
Jeśli przyczyną neutropenii są niedobory kwasu foliowego lub witaminy B12 leczeniem będzie uzupełnienie tych witamin z dietą i/lub suplementacją.
U pacjenta z neutropenią w przebiegu wymienionych chorób zwiększa się ryzyko wystąpienia infekcji i gorączki neutropenicznej. Dlatego osoby z tym zaburzeniem powinny przestrzegać zasad, które zapobiegają zakażeniom. Mycie rąk wodą i mydłem, unikanie tłumnych miejsc.
Dzieci z neutropenią łagodną i umiarkowaną mogą chodzić do przedszkola i do szkoły, jednak powinny unikać kontaktu z dziećmi chorymi. W przypadku ciężkiej neutropenii wymagana jest jednak ściślejsza izolacja.
W zapobieganiu zakażeniom – zarówno u osób dorosłych, jak i dzieci – szczególnie ważna jest higiena jamy ustnej i opieka stomatologiczna.
>> Warto wiedzieć: Jak wzmocnić układ immunologiczny u dorosłych i dzieci?
Neutropenia – podsumowanie
Neutropenia jest zaburzeniem dosyć często występującym. O postępowaniu z pacjentem, który ma neutrofile poniżej, normy decyduje wiele czynników. Jednym z podstawowych jest przyczyna wystąpienia tego zaburzenia oraz jaki jest poziom granulocytów obojętnochłonnych. Dlatego zawsze w przypadku niepokojących wyników morfologii należy skonsultować się z lekarzem, który zadecyduje o dalszym postępowaniu.
Bibliografia
- Stefaniuk P., Szymczyk A., Podhorecka M., Neutropenia dorosłych jako istotny problem diagnostyczny, Pielęgniarstwo XXI wieku 2018. doi: 10.2478/pielxxiw-2018-0006. (dostęp 17.02.2025)
- https://podyplomie.pl/wiedza/wielka-interna/745,struktura-hemoglobiny-charakterystyka-krwi-i-elementow-morfotycznych. (dostęp 17.02.2025)
- Segel George B., Halterman Jill S., Neutropenia w praktyce pediatrycznej, Pediatria po Dyplomie, 2009. (dostęp 17.02.2025)