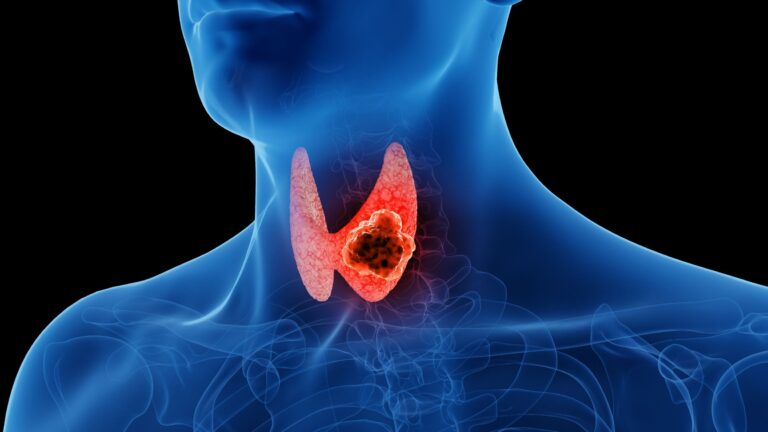
Rak brodawkowaty tarczycy to najczęstszy nowotwór złośliwy tego gruczołu, stanowiący około 80% wszystkich przypadków raka tarczycy. Choć jest nowotworem złośliwym, wyróżnia się stosunkowo dobrym rokowaniem. Jakie są jego przyczyny i objawy? Jak wygląda diagnostyka oraz leczenie? Odpowiedzi na te pytania znajdziesz w poniższym artykule.
Spis treści:
- Przyczyny raka brodawkowatego tarczycy
- Diagnostyka raka brodawkowatego tarczycy
- Leczenie raka brodawkowatego tarczycy
- Ile się żyje z rakiem brodawkowatym tarczycy?
- Podsumowanie
Przyczyny raka brodawkowatego tarczycy
Przyczyny raka brodawkowatego tarczycy nie są do końca poznane, jednak w literaturze medycznej wyróżnia się kilka czynników ryzyka:
- Promieniowanie jonizujące – ekspozycja na promieniowanie, zwłaszcza w dzieciństwie, uważa się za czynnik znacząco zwiększający ryzyko zachorowania. Wpływ ten jest szczególnie zauważalny u osób poddanych radioterapii w okolicy głowy i szyi.
- Czynniki genetyczne – uważane są za mające mniejsze znaczenie w występowaniu raka brodawkowatego tarczycy. Mutacja genu BRAF V600E jest najczęściej obserwowaną zmianą genetyczną w tym typie raka tarczycy i wiąże się z bardziej agresywnym przebiegiem choroby.
- Nadmiar jodu– przewlekły nadmiar tego pierwiastka może przyczyniać się do rozwoju brodawkowatego raka tarczycy (w przeciwieństwie do raka pęcherzykowatego, dla którego za czynnik ryzyka uważa się niedobór jodu).
- Choroby tarczycy – niektóre doniesienia naukowe sugerują, że choroba Hashimoto może zwiększać ryzyko rozwoju raka brodawkowatego, jednakże mechanizm tego zjawiska nie jest jednak w pełni wyjaśniony.
Co więcej, rak brodawkowaty tarczycy jest rozpoznawalny częściej u kobiet niż u mężczyzn, a zapadalność na niego wzrasta wraz z wiekiem.
>> Przeczytaj także: Jod – rola w organizmie, źródła, nadmiar i niedobór jodu
Diagnostyka raka brodawkowatego tarczycy
Diagnostyka raka brodawkowatego tarczycy obejmuje szereg badań, które pozwalają na dokładne określenie rodzaju zmiany i ewentualne monitorowanie dalszego leczenia:
- Badanie podmiotowe i przedmiotowe – pacjenci mogą niekiedy zgłaszać objawy takie jak chrypka, trudności w połykaniu, uczucie ucisku w szyi lub wyczuwalne powiększone węzły chłonne. W badaniu palpacyjnym lekarz może wykryć obecność guzka w obrębie tarczycy – warto jednak podkreślić, że rak brodawkowaty tarczycy może latami nie dawać żadnych objawów i najczęściej zostaje wykryty przypadkowo.
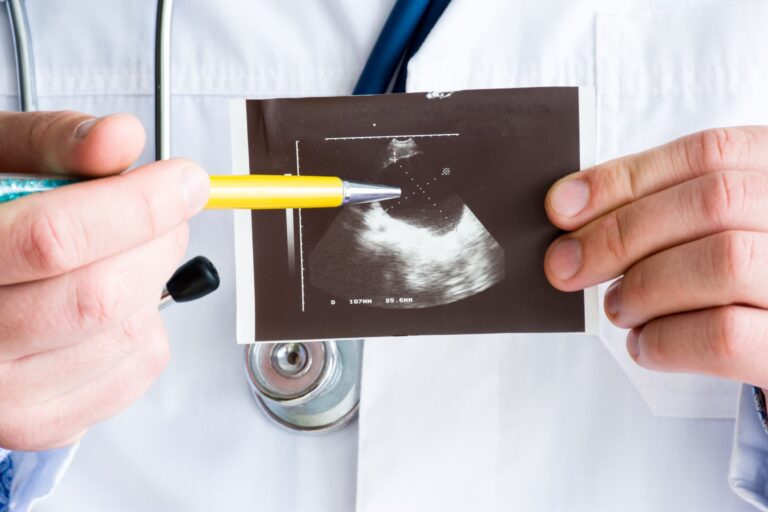
- Badanie ultrasonograficzne (USG) – podstawowe narzędzie do obrazowania zmian ogniskowych w tarczycy. W ocenie zmian ogniskowych w obrębie gruczołu stosuje się skalę EU-TIRADS PL, która rozróżnia zmiany od łagodnych (EU-TIRADS PL 1) po wysoce podejrzane (EU-TIRADS PL 5) i klasyfikuje je do BACC. Zmiany ogniskowe oznaczone jako EU-TIRADS PL 4 i 5 wymagają dalszej diagnostyki. W badaniu ultrasonograficznym wskazana jest również ocena okolicznych węzłów chłonnych.
- Biopsja cienkoigłowa celowana (BACC) – pobranie materiału z podejrzanej zmiany do badania histopatologicznego. Należy pamiętać, że raka tarczycy rozpoznaje się dopiero na podstawie analizy materiału pobranego podczas zabiegu operacyjnego, a rozpoznanie ustalone w oparciu o BACC jest jedynie rozpoznaniem wstępnym.
- Badania laboratoryjne (tzw. pakiet tarczycowy) – oznaczanie poziomu TSH oraz hormonów tarczycy w celu wykluczenia zaburzeń czynności tarczycy, a po przebytej tyreoidektomii – monitorowania leczenia preparatem L-tyroksyny.
- Tomografia komputerowa (TK) i rezonans magnetyczny (MRI) – stosowane w przypadku podejrzenia przerzutów.
Leczenie raka brodawkowatego tarczycy
Podstawą leczenia jest zabieg chirurgiczny, który w zależności od kryteriów klinicznych, cytologicznych, ultrasonograficznych, technicznych może obejmować:
- Tyreoidektomię całkowitą – usunięcie całej tarczycy.
- Lobektomię – usunięcie tylko jednego płata tarczycy.
Ponadto pacjenci poddawani są również:
- Uzupełniającemu leczeniu jodem radioaktywnym – stosowanym po operacji w celu zniszczenia pozostałych komórek nowotworowych i prewencji ewentualnej wznowie choroby.
- Terapii hormonalnej – pacjenci po zabiegu tyreoidektomii wymagają terapii substytucyjnej L-tyroksyną, aby utrzymać prawidłowe funkcje regulacyjne organizmu.
- Kontrolom onkologicznym – regularne badania kontrolne, w tym badanie ultrasonograficzne, są niezbędne dla monitorowania ewentualnych wznów choroby.
>> Warto wiedzieć czym jest: Niedoczynność tarczycy
Czy rak brodawkowaty tarczycy jest wyleczalny?
Rak brodawkowaty tarczycy jest jednym z najlepiej rokujących nowotworów. Charakteryzuje się powolnym wzrostem, niską agresywnością oraz wysoką skutecznością leczenia. Dzięki zaawansowanym metodom chirurgicznym oraz leczeniu uzupełniającemu, takim jak terapia jodem radioaktywnym, ryzyko wznowy choroby jest niewielkie. Co więcej, większość pacjentów po leczeniu może prowadzić normalne życie, bez większych ograniczeń. Odpowiednia kontrola endokrynologiczna i regularne badania kontrolne pozwalają na monitorowanie stanu zdrowia i szybkie wykrycie ewentualnych niepokojących zmian.
Czy rak brodawkowaty tarczycy daje przerzuty?
Rak brodawkowaty tarczycy rzadko daje przerzuty odległe, jednak może rozprzestrzeniać się do okolicznych węzłów chłonnych. Przerzuty do płuc czy kości występują sporadycznie i dotyczą głównie zaawansowanych przypadków. Dzięki skutecznej diagnostyce oraz leczeniu możliwe jest ograniczenie ryzyka przerzutów i kontrolowanie choroby.
Ile się żyje z rakiem brodawkowatym tarczycy?
Rokowania w przypadku raka brodawkowatego tarczycy są bardzo dobre. Wskaźnik przeżycia 10-letniego wynosi ponad 90%, a w przypadku młodych pacjentów nawet 98%. Kluczowe znaczenie ma wczesna diagnostyka i odpowiednie leczenie, które pozwala na długie i zdrowe życie.
Podsumowanie
Rak brodawkowaty tarczycy to nowotwór o wysokim wskaźniku wyleczalności i stosunkowo łagodnym przebiegu. Mimo to jego wczesne wykrycie jest kluczowe dla skutecznego leczenia i uniknięcia powikłań. W ostatnich latach odnotowuje się wzrost liczby przypadków raka tarczycy, co może wynikać zarówno z lepszej diagnostyki, jak i czynników środowiskowych. Regularne badania USG tarczycy, szczególnie u osób z grupy ryzyka, pozwalają na szybkie rozpoznanie zmian nowotworowych i wdrożenie odpowiedniego leczenia. Jeśli zauważysz u siebie objawy takie jak przewlekła chrypka, trudności w połykaniu lub wyczuwalny guzek na szyi, nie zwlekaj – skonsultuj się z endokrynologiem.
Bibliografia
- Lewiński A., „Diagnostyka i leczenie chorób tarczycy”, Wydawnictwo Medyczne, 2020.
- Zygmunt A.,”Nowotwory tarczycy – aspekty kliniczne i molekularne”, Endokrynologia Polska, 2021.
- Lewiński A., „Rak tarczycy – epidemiologia i patogeneza”, Medycyna Praktyczna, 2018.
- Jarząb B., „Diagnostyka i leczenie raka tarczycy u chorych dorosłych – Rekomendacje Polskich Towarzystw Naukowych oraz Narodowej Strategii Onkologicznej. Aktualizacja na rok 2022.” Endokrynologia Polska, 2022.