Potworniak jajnika, znany również jako teratoma jajnika, to nowotwór wywodzący się z komórek zarodkowych. Choć w większości przypadków ma charakter łagodny, może prowadzić do poważnych powikłań. W artykule wyjaśnimy, czym jest potworniak jajnika, jak się objawia, jakie są jego przyczyny oraz jak przebiega diagnostyka i leczenie. Regularne badania ginekologiczne są kluczowe dla wczesnego wykrycia tej zmiany, dlatego warto zapoznać się z poniższymi informacjami.
Spis treści:
- Czym jest potworniak jajnika?
- Potworniak jajnika: jak wygląda?
- Objawy potworniaka jajnika
- Teratoma jajnika: przyczyny nowotworu
- Diagnoza potworniaka jajnika. Kiedy operować?
- Potworniak jajnika: leczenie
- Podsumowanie
Czym jest potworniak jajnika?
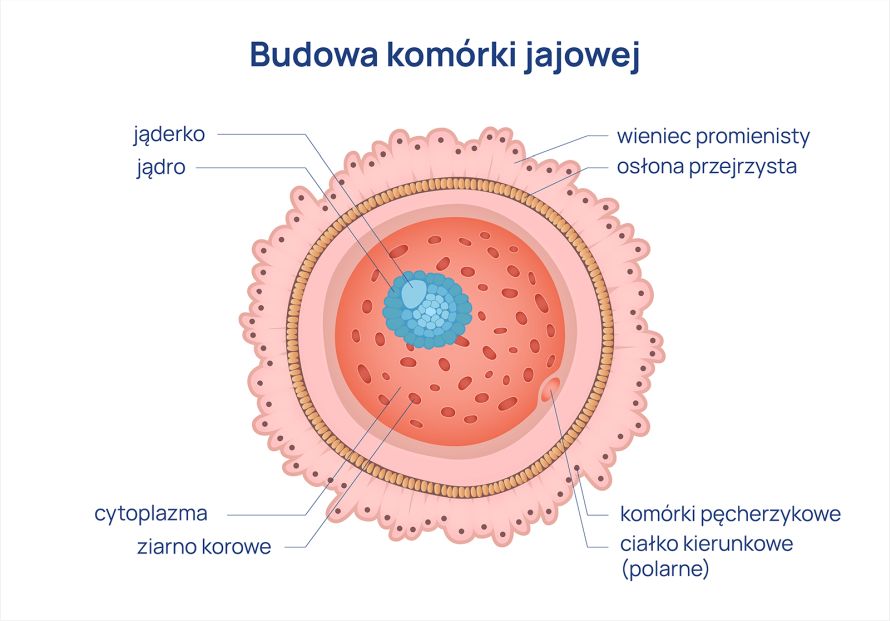
Potworniak jajnika to nowotwór germinalny, który powstaje z komórek rozrodczych zdolnych do różnicowania się w różne typy tkanek. Może zawierać elementy włosów, skóry, zębów, a nawet tkanki nerwowej czy mięśniowej. Wyróżnia się dwa główne typy potworniaków:
- Potworniak dojrzały – łagodny nowotwór, najczęstsza postać tej zmiany.
- Potworniak niedojrzały – nowotwór potencjalnie złośliwy, wymagający bardziej agresywnego leczenia.
Potworniaki stanowią od 10% do 20% wszystkich nowotworów jajnika, co czyni je stosunkowo częstymi zmianami. Czasami współwystępują z innymi torbielami jajnika, co może komplikować ich diagnostykę.
>> Zobacz też: Rak jajnika – objawy, czynniki ryzyka, diagnostyka laboratoryjna
Potworniak jajnika: jak wygląda?
Potworniaki dojrzałe mają postać torbieli skórzastych, wypełnionych gęstą substancją i fragmentami różnych tkanek. Mogą zawierać struktury takie jak włosy, gruczoły łojowe, kości czy zęby. W obrazach ultrasonograficznych zazwyczaj widoczne są charakterystyczne zwapnienia i tkanki o różnej gęstości. W niektórych przypadkach w badaniu USG można dostrzec strukturę przypominającą zarys twarzy, co wynika z obecności tkanki kostnej.
Potworniaki niedojrzałe są mniej zorganizowane pod względem budowy i mają tendencję do szybszego wzrostu. Mogą mieć bardziej nieregularną strukturę i rozległe unaczynienie, co zwiększa ryzyko ich potencjalnej złośliwości. W niektórych przypadkach mogą naciekać sąsiednie tkanki lub powodować przerzuty, dlatego wymagają szybkiej interwencji medycznej.
Objawy potworniaka jajnika
Wiele pacjentek nie odczuwa objawów, a guz jest wykrywany przypadkowo podczas badań obrazowych. Jednak w miarę wzrostu może powodować szereg dolegliwości, które mogą być mylone z innymi schorzeniami ginekologicznymi lub gastrycznymi. Do najczęstszych objawów należą:
- Ból w podbrzuszu – może mieć charakter tępy, okresowy lub stały, a w przypadku skrętu guza może wystąpić nagły, bardzo silny ból,
- Uczucie pełności i dyskomfortu – powiększający się guz może uciskać sąsiednie narządy, powodując uczucie rozpierania w brzuchu,
- Zaburzenia menstruacyjne – nieregularne miesiączki, plamienia międzymiesiączkowe, nasilone bóle miesiączkowe,
- Problemy z oddawaniem moczu lub wypróżnianiem – w zależności od lokalizacji guza może on uciskać pęcherz lub jelita, powodując trudności w oddawaniu moczu lub zaparcia,
- Nudności i wymioty – mogą wystąpić w zaawansowanych przypadkach, zwłaszcza jeśli dochodzi do skrętu jajnika,
- Powiększenie obwodu brzucha – w przypadku dużych zmian torbielowatych może dojść do wyraźnego powiększenia brzucha, co jest często mylone z przyrostem masy ciała.
W przypadkach nagłych, takich jak skręt guza lub jego pęknięcie, mogą pojawić się objawy ostrego brzucha wymagające natychmiastowej hospitalizacji.
Teratoma jajnika: przyczyny nowotworu
Dokładne przyczyny powstawania potworniaka jajnika nie są znane. Uważa się, że rozwija się on z pluripotencjalnych komórek zarodkowych, które w wyniku błędów w różnicowaniu zaczynają tworzyć różne typy tkanek. Możliwe czynniki ryzyka to predyspozycje genetyczne oraz zaburzenia w podziałach komórkowych we wczesnym okresie rozwoju.
Niektóre badania wskazują, że zaburzenia hormonalne mogą odgrywać rolę w rozwoju tego typu nowotworów. Chociaż nie ma jednoznacznych dowodów na wpływ czynników środowiskowych na rozwój potworniaków, spekuluje się, że niektóre substancje chemiczne lub czynniki mutagenne mogą sprzyjać ich powstawaniu. Nadal jednak potrzeba dalszych badań, aby dokładnie zrozumieć mechanizmy prowadzące do rozwoju potworniaka jajnika.
>> Przeczytaj także artykuł: Równowaga hormonalna u kobiet
Diagnoza potworniaka jajnika. Kiedy operować?
Diagnostyka potworniaka jajnika obejmuje:
- Badanie ginekologiczne – wykrycie guza w okolicy jajnika,
- Ultrasonografii (USG) – pozwala ocenić wielkość i strukturę guza,
- Tomografii komputerowej (TK) lub rezonansu magnetycznego (MRI) – bardziej szczegółowa ocena zmian,
- Oznaczenie markerów nowotworowych – np. AFP czy hCG, choć w potworniakach dojrzałych rzadko są podwyższone. Wskazane może być również pogłębienie diagnostyki o oznaczenie testu ROMA.


Operacja jest zalecana w przypadku:
- Potwierdzenia obecności potworniaka niedojrzałego,
- Występowania objawów,
- Ryzyka powikłań, np. skrętu guza,
- Dużego rozmiaru guza.

Potworniak jajnika: leczenie
Podstawową metodą leczenia jest zabieg chirurgiczny, w zależności od sytuacji może to być:
- Cystektomia – usunięcie samego guza z zachowaniem jajnika,
- Owariektomia – usunięcie całego jajnika,
- Salpingo-owariektomia – usunięcie jajnika wraz z jajowodem.
W przypadku potworniaków niedojrzałych konieczna może być chemioterapia, zwłaszcza jeśli istnieje ryzyko przerzutów lub nowotwór został wykryty w zaawansowanym stadium.
Potworniak dojrzały i niedojrzały jajnika: rokowania
Rokowania potworniaka jajnika zależą od jego typu i stopnia zaawansowania.
- Potworniak dojrzały – ma bardzo dobre rokowania, a jego usunięcie zwykle całkowicie rozwiązuje problem. Ryzyko nawrotu jest niewielkie, a pacjentki mogą normalnie funkcjonować po operacji.
- Potworniak niedojrzały – wymaga agresywniejszego leczenia. Rokowania zależą od stadium nowotworu, ale wczesne wykrycie znacznie zwiększa szanse na pełne wyleczenie. W zaawansowanych przypadkach konieczna może być chemioterapia, a długoterminowe rokowania mogą być mniej korzystne.
- Czynniki wpływające na rokowanie – wielkość guza, stopień złośliwości, obecność przerzutów oraz czas, w którym postawiono diagnozę.
Regularne kontrole ginekologiczne i badania obrazowe pozwalają na wczesne wykrycie potworniaka, co znacząco wpływa na skuteczność leczenia.
Podsumowanie
Potworniak jajnika to nowotwór, który często przebiega bezobjawowo, ale może prowadzić do poważnych komplikacji. Regularne badania ginekologiczne pozwalają na wczesne wykrycie i skuteczne leczenie tego schorzenia. Jeśli doświadczasz niepokojących objawów, skonsultuj się z lekarzem i wykonaj odpowiednie badania. Wczesna diagnoza to klucz do zdrowia i uniknięcia poważnych konsekwencji. Nie lekceważ objawów i dbaj o regularne kontrole!
Bibliografia
- Rak J., Malinowski A. „Nowotwory germinalne jajnika”. Ginekologia Polska, 2020.
- Smith J. et al., „Ovarian Teratomas: Diagnosis and Management”, Journal of Gynecologic Oncology, 2019.
- WHO Classification of Tumours: Female Genital Tumours, 5th Edition, 2020.