Spis treści:
- Czym jest zespół alfa-gal (alfa-gal syndrom)?
- W jaki sposób kleszcze biorą udział w powstawaniu alfa-gal syndrom?
- Co to jest galaktoza-α-1,3-galaktoza?
- Objawy alfa-gal syndrom
- Historia pacjenta z alfa-gal syndrom
- Diagnostyka zespołu alfa-gal
- Leczenie zespołu alfa-gal
- Źródła alfa-gal w diecie człowieka
- Zapobieganie alfa-gal syndrom
Czym jest zespół alfa-gal (alfa-gal syndrom)?
Alfa-gal syndrom (ang. alpha-gal syndrome) to alergia na czerwone mięso, wywołana przez ukąszenie kleszcza. Coraz więcej dowodów wskazuje na to, iż niektóre ukąszenia kleszczy mogą być związane nie tylko z boreliozą, ale też wywoływać zagrażającą życiu alergię na czerwone mięso oraz produkty mięsne.
U części pacjentów ukąszenie kleszcza powoduje alergię na cukier galaktozę-α-1,3-galaktozę, nazywaną również alfa-gal. Jest to oligosacharyd występujący w mięsie większości ssaków (innych niż naczelne), nie znajdziemy go w mięsie drobiu lub ryb.
Alergia na czerwone mięso wywołana przez ukąszenie kleszcza notowana jest na całym świecie. Opisano przypadki zachorowań w Azji, w Australii, Europie i USA. W Stanach Zjednoczonych w roku 2009 zarejestrowano 12 przypadków alfa-gal syndrom, w roku 2019 już 34 tys. (!). Niestety AGS (alfa-gal syndrom) nie ma swojego kodu w rejestrze chorób, nie podlega również obowiązkowi zgłoszenia CDC. Z tego powodu eksperci są zgodni, iż w tych obszarach geograficznych, gdzie kleszcze są powszechne, liczba zgłaszanych zachorowań jest niedoszacowana i w istocie jest ich dużo więcej.
W jaki sposób kleszcze biorą udział w powstawaniu alfa-gal syndrom?
Wiadomo, iż kleszcze przenoszą wiele patogenów mogących wywoływać choroby odkleszczowe. Najczęstszą z nich jest borelioza, wywoływana przez bakterię Borrelia burgdorferi. Inną niebezpieczną chorobą przenoszoną przez kleszcze jest KZM (kleszczowe zapalenie mózgu), wywoływane przez wirusa.
Obecnie uważa się, iż w ślinie kleszcza znajduje się również alfa-gal pochodzący z krwi zwierząt, na których kleszcze pasożytują (np. krowy, owce). Nie jest to patogen, lecz oligosacharyd, który wstrzyknięty ze śliną kleszcza powoduje powstawanie swoistych przeciwciał IgE, będących początkiem odpowiedzi immunologicznej w organizmie człowieka. Wiadomo, iż kleszcze mogą przenosić wiele patogenów jednocześnie, mogą przenosić tylko jeden z nich, mogą również być przyczyną zespołu alfa-gal w połączeniu z boreliozą, jak i samego syndromu alergii na czerwone mięso. Niestety każde ukąszenie kleszcza niesie za sobą ryzyko wszystkich chorób odkleszczowych oraz AGS (alfa-gal syndrom).
Na dziś powtarzające się ukąszenia przez kleszcze pozostają najpoważniejszym czynnikiem ryzyka syndromu alfa-gal. Nie znamy odpowiedzi na pytanie, dlaczego nie każda osoba ugryziona przez kleszcza rozwinie AGS (alfa-gal syndrom), jednak z pewnością, jeśli u osoby niedawno ugryzionej przez kleszcza wystąpi nagła reakcja anafilaktyczna, lub powracają objawy żołądkowo-jelitowe, lub wystąpi pokrzywka, należy rozważyć alfa-gal syndrom.
Co to jest galaktoza-α-1,3-galaktoza?
Alfa-gal to oligosacharyd, czyli cukier występujący w komórkach ssaków. W procesie ewolucji człowiek (Homo sapiens) utracił zdolność do syntezy tego węglowodanu, dlatego – jeśli dostanie się do ludzkiego organizmu – wywołuje odpowiedź układu odpornościowego. Według badań odgrywa ważną rolę w rozwoju alergii na czerwone mięso, z zagrażającą życiu reakcją anafilaktyczną włącznie.
Objawy alfa-gal syndrom
Objawy zespołu alfa-gal mogą obejmować symptomy z przewodu pokarmowego, oddechowego oraz problemy skórne. Ich cechą charakterystyczną jest fakt, iż występują z dużym opóźnieniem po spożyciu posiłku (3-6, a nawet 8 godzin), co znacznie utrudnia wywnioskowanie, co jest ich przyczyną. Jest to tym trudniejsze, iż większość znanych alergii pokarmowych wywołuje reakcję natychmiastową, natomiast jeśli pacjent budzi się o 3 nad ranem z powodu poważnej reakcji alergicznej, nie przychodzi mu do głowy, aby powiązać te objawy ze zjedzonym poprzedniego dnia hamburgerem.
Objawy:
- 90% pacjentów odczuwa problemy skórne: swędząca wysypka, zaczerwienienie w postaci rumienia, pokrzywka, obrzęk naczynioruchowy;
- 60% osób odczuwa problemy ze strony przewodu pokarmowego: bóle brzucha, biegunki, zgagę, skurcze jelit, wymioty;
- ok. 30 % pacjentów doświadcza objawów ze strony układu krążenia: gwałtowny spadek ciśnienia tętniczego, kołatania serca;
- ok. 30% osób odczuwa objawy ze strony układu oddechowego: świszczący oddech, kaszel, duszności;
- Inne: obrzęk ust, gardła, języka, powiek, zawroty głowy.
Wystąpienie alfa-gal syndrom mogą nasilać tzw. kofaktory:
- alkohol,
- wysiłek fizyczny,
- niesterydowe leki przeciwzapalne,
- infekcje.
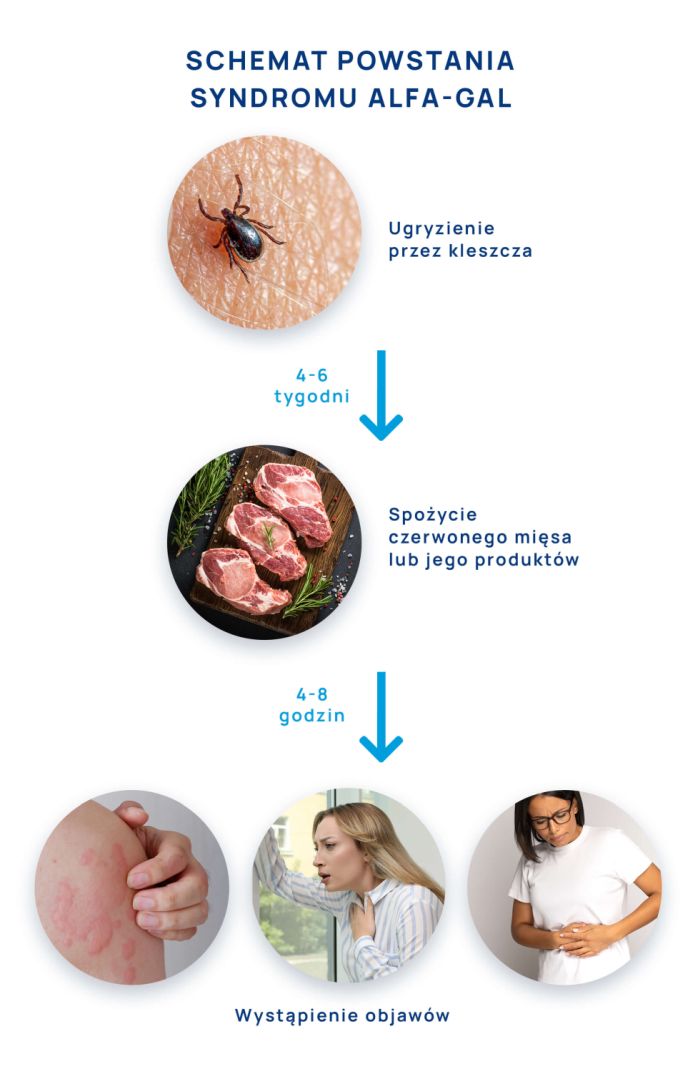
Historia pacjenta z alfa-gal syndrom
Pacjent został ukąszony przez kleszcza w czerwcu 2017 roku. Pacjent czuł się dobrze, badania również nie potwierdziły boreliozy. Jednak po pewnym czasie zaczął odczuwać kłopoty zdrowotne – często po jedzeniu odczuwał mdłości, skurcze jelit, zaobserwował biegunki. Podejrzewano zespół jelita nadwrażliwego.
W ciągu następnych kilku miesięcy wystąpiło kilka epizodów pokrzywki. Zdiagnozowano atopowe zapalenie skóry, jednak leczenie przepisane przez dermatologa nie pomagało. W kwietniu 2018 roku pacjent zaczął odczuwać kaszel i duszności, przeprowadzono liczne testy w kierunku alergii pokarmowej, jednak nie wykryto przyczyn tych dolegliwości.
W lipcu pacjent uczestniczył w rodzinnym grillu, po którym bardzo źle się poczuł. Wystąpiły bóle głowy, gwałtowne wymioty. Zebrany przez lekarza wywiad potwierdził, iż kilka godzin przed wystąpieniem objawów pacjent spożywał czerwone mięso, a ponad rok wcześniej ukąsił go kleszcz. Przeprowadzone testy alergiczne potwierdziły podejrzenie, iż pacjent cierpi na zespół alfa-gal.
Diagnostyka zespołu alfa-gal
Diagnostyka choroby opiera się na podstawie wywiadu, objawów klinicznych, oraz dodatniego wyniku badania krwi. Jeśli u pacjenta występują objawy po zjedzeniu mięsa ssaków lub jego produktów, a kilka tygodni wcześniej ukąsił go kleszcz, należy wykonać badanie laboratoryjne – oznaczenie przeciwciał IgE przeciwko alfa-gal. Materiałem do badania jest krew, pacjent nie musi się do niego przygotowywać.

Należy podkreślić, iż ok. 30% pacjentów nie pamięta epizodu ukąszenia przez kleszcza, jednak nie powinno to wykluczać diagnostyki.
WAŻNE: Badania określające poziom galaktozy w organizmie człowieka nie służą do diagnostyki syndromu alfa-gal.
Leczenie zespołu alfa-gal
Podobnie jak w leczeniu większości alergii, podstawą postępowania jest unikanie alergenów.
Chory powinien unikać:
- mięsa ssaków,
- produktów zawierających białka ssaków,
- leków zawierających białko ssaków.
Na dziś nie mamy innego leczenia niż unikanie czerwonego mięsa i innych produktów wytwarzanych z białek ssaków.
Źródła alfa-gal w diecie człowieka
Źródłem alfa-gal w diecie człowieka jest czerwone mięso – wołowina, wieprzowina, jagnięcina, dziczyzna, mięso kozy. Cukru galaktoza-α-1,3-galaktozy nie zawiera mięso drobiowe oraz ryby.
Niestety AGS może być wywoływany również przez pokarmy pochodzące od ssaków, takich jak smalec, śmietana, mleko, sery, lody, chociaż większość pacjentów dobrze toleruje mleczne produkty.
Innym źródłem galaktozy-α-1,3-galaktozy jest żelatyna, która jest składnikiem galaretek, ale również żelek, pianek czy puddingów.

Należy również uważać na ukryte źródła alfa-gal, np. kiełbasa z kurczaka lub indyka może mieć wieprzową osłonkę, a smalec znajduje się w wielu gotowych produktach (sosy, zupy, chipsy, itp.).
Reakcję alfa-gal mogą wywołać również niektóre leki (żelatynowe kapsułki), nieoznakowane „naturalne aromaty” żywności czy suplementy kolagenu.
Zapobieganie alfa-gal syndrom
Zapobieganie zespołowi alfa-gal polega na zapobieganiu ukąszeniom przez kleszcza. Jeśli zauważymy kleszcza wbitego w naszą skórę, należy go jak najszybciej usunąć. Szczegółowe informacje o tym, jak zapobiegać ukąszeniom przez kleszcza oraz jak go prawidłowo usunąć, znajdziesz w artykule Sezon na kleszcze.