Spis treści:
- Różne czynniki etiologiczne i sposób przenoszenia ospy wietrznej i ospy małpiej
- Zakaźność ospy wietrznej i ospy małpiej
- Objawy ospy wietrznej
- Objawy ospy małpiej
- Diagnostyka ospy wietrznej i ospy małpiej
- Leczenie ospy wietrznej i ospy małpiej
Pojawienie się w Europie, w tym w Polsce, przypadków małpiej ospy spowodowało liczne dyskusje na temat związków tej choroby z ospą wietrzną. Powstało wiele mitów o ich podobieństwie, które warto sprostować. Tak naprawdę jedyną ich wspólną cechą jest to, że są to choroby zakaźne wywoływane przez wirusy.
Różne czynniki etiologiczne i sposób przenoszenia ospy wietrznej i ospy małpiej
Ospa wietrzna jest wywoływana przez wirusa ospy wietrznej i półpaśca (Varicella zoster virus – VZV) należącego do rodzaju Varicellovirus z rodziny Herpesviridae. Wirus, wnikając po raz pierwszy do organizmu, wywołuje objawy ospy wietrznej a następnie dostając się do zwojów rdzeniowych i nerwów czaszkowych przechodzi w stan uśpienia, który może trwać wiele lat. Następstwem obniżenia odporności organizmu u osób, które przeszły ospę wietrzną, może być reaktywacja wirusa i pojawienie się objawów charakterystycznych dla półpaśca.
Jedynym rezerwuarem VZV jest człowiek. Do zakażenia dochodzi głównie drogą kropelkową, ale możliwe jest też przenoszenie wirusów przez kontakt bezpośredni lub przez łożysko.
Ospa małpia wywoływana jest przez wirusa ospy małpiej (Monkeypox virus -MPXV) należącego do rodzaju Orthopoxvirus z rodziny Poxviridae.
Małpia ospa to choroba odzwierzęca, a rezerwuarem wirusów są głównie gryzonie (wiewiórki, szczury, króliki), rzadziej różne gatunki małp i inne zwierzęta. Do zakażenia ospą małpią dochodzi na skutek pogryzienia lub kontaktu z krwią i innymi płynami ustrojowymi zwierząt. Między ludźmi wirus przenosi się drogą kropelkową, ale jest to zjawisko bardzo rzadkie i wymaga bliskiego, przedłużonego kontaktu z chorym na ospę małpią. Możliwe jest też również zakażenie na skutek kontaktu z krwią i wydzielinami osoby zakażonej małpią ospą.
Zakaźność ospy wietrznej i ospy małpiej
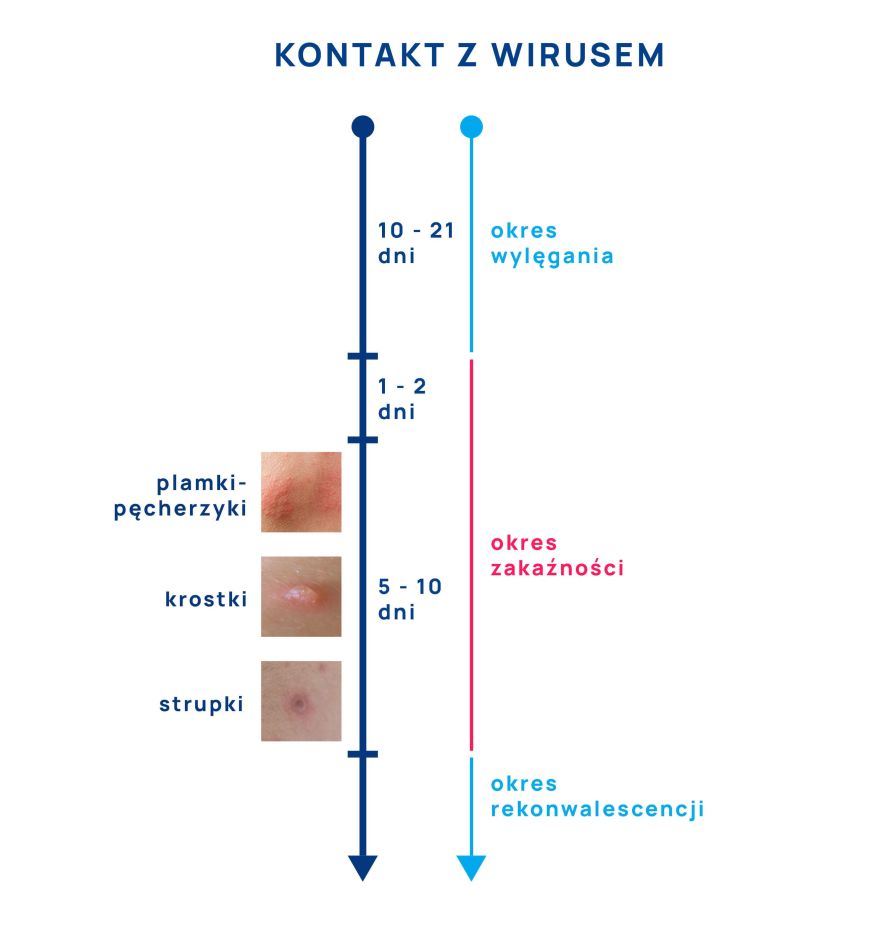
Ospa wietrzna – okres wylęgania trwa 10-21 dni (średnio 14 dni), zakaźność jest bardzo wysoka i wynosi > 90%. Chory na ospę wietrzną staje się źródłem zakażenia dla osób z otoczenia na 1-2 dni przed pojawieniem się u niego wysypki i pęcherzyków, a zakaźność utrzymuje się do momentu zamiany pęcherzyków w strupki, które po pewnym czasie odpadają.
Ospa małpia – okres wylęgania trwa 5-21 dni (najczęściej 6-13 dni), zakaźność jest niska, do zakażenia dochodzi głównie przez kontakt bezpośredni z wydzieliną z chorobowych zmian skórnych. Osoba chora na ospę małpią jest zakaźna przez cały okres występowania wysypki.
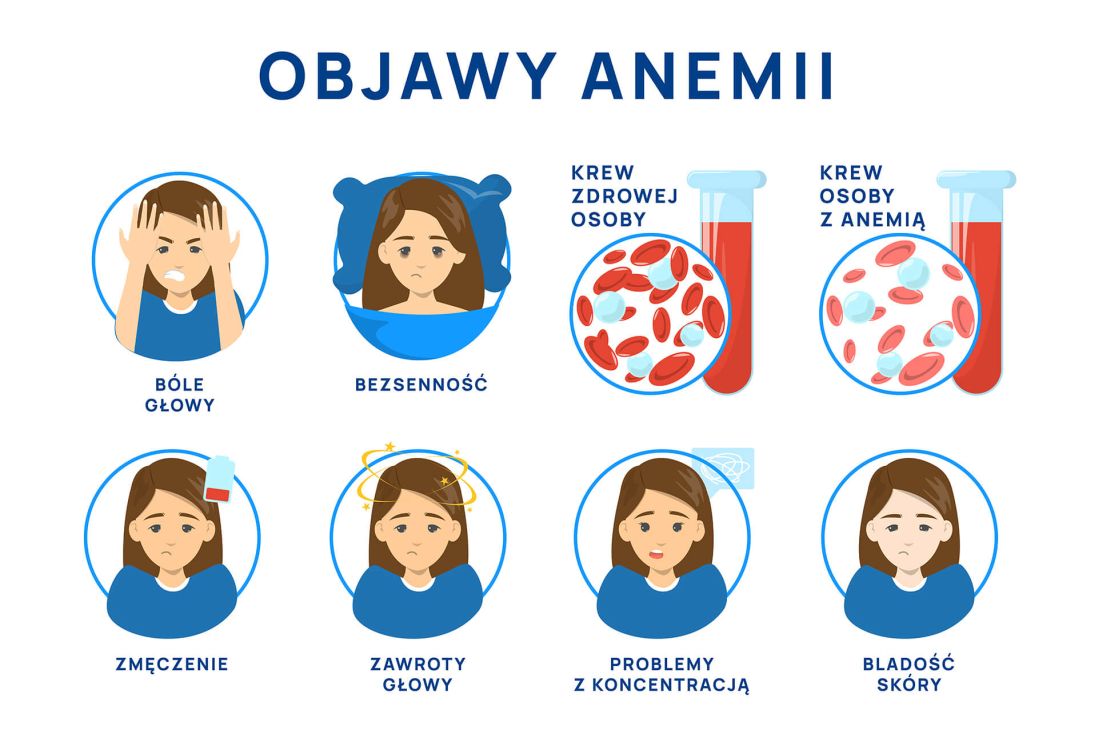
Objawy ospy wietrznej
Ospa wietrzna rozpoczyna się niespecyficznymi objawami zwiastunowymi trwającymi z reguły 1-2 dni, po których następuje okres osutkowy charakteryzujący się zmianami na skórze i błonach śluzowych. Wysypce może towarzyszyć świąd, pieczenie skóry oraz gorączka.
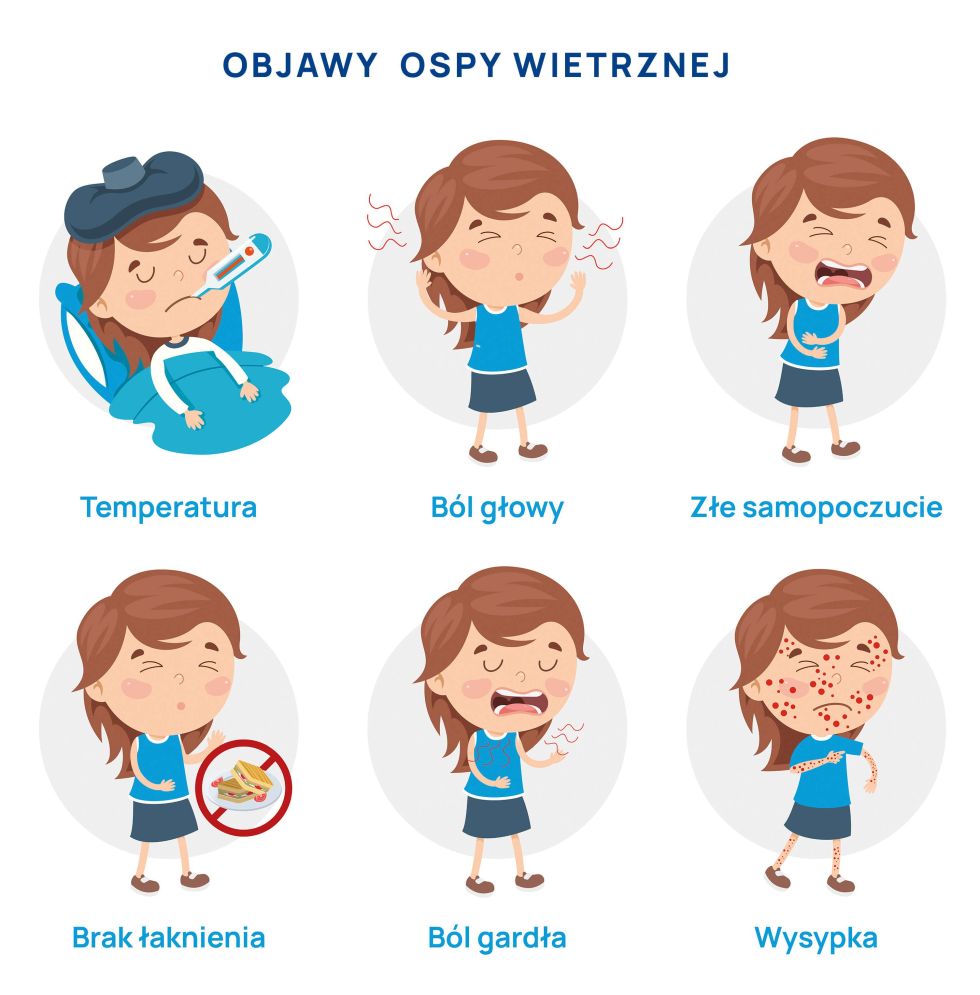
Okres zwiastunowy:
- gorączka lub stan podgorączkowy,
- złe samopoczucie,
- bóle głowy i mięśni,
- zapalenie gardła, nieżyt nosa,
- brak łaknienia,
- zaczerwienienie skóry,
- ból brzucha, rzadziej biegunka.
Okres wysypkowy (osutkowy):
Wysypka przechodzi przez różne fazy rozwoju. Początkowo są to rumieniowe plamki przemieniające się w grudki i pęcherzyki wypełnione płynem. Po 2-3 dniach pojawiają się krostki, które po kolejnych 3-4 dniach zasychają w strupki.
Wysypka pojawia się na głowie, tułowiu, ramionach, kończynach dolnych i rękach. W 10-20% przypadków zmiany pojawiają się również na błonie śluzowej jamy ustnej, gardła, narządów płciowych oraz na spojówkach i rogówce. W pełni choroby zmiany osutkowe występują we wszystkich postaciach rozwoju.
Ospa wietrzna trwa z reguły 5-10 dni. Choroba u osób z prawidłową odpornością ma przebieg łagodny i pozostawia po sobie odporność na całe życie. Przebarwienia, jakie pozostają na skórze po odpadnięciu strupków, z czasem ustępują i najczęściej nie pozostawiają widocznych śladów. U osób z grupy ryzyka przebieg ospy wietrznej bywa dłuższy i cięższy, a także częściej po chorobie mogą występować powikłania.
Czynniki ryzyka ciężkiego przebiegu i powikłania ospy wietrznej
Czynniki ryzyka ciężkiego przebiegu ospy wietrznej:
- wrodzone lub nabyte niedobory odporności komórkowej,
- wiek (noworodki),
- ciąża,
- immunosupresja,
- przewlekłe choroby skóry,
- mukowiscydoza,
- astma.
Najczęstsze powikłania ospy wietrznej:
- wtórne bakteryjne zakażenia zmian skórnych,
- zapalenie płuc (ospowe, bakteryjne),
- objawy neurologiczne (zapalenie mózgu, móżdżku, opon mózgowo-rdzeniowych).
Objawy ospy małpiej
Choroba rozpoczyna się od niespecyficznych objawów zwiastunowych trwających 1-3 dni, następnie pojawia się wysypka przechodząca przez stadium plamki, grudki, pęcherzyka, krosty aż po strupek.
Objawy zwiastunowe:
- wysoka gorączka,
- uogólnione lub miejscowe powiększenie węzłów chłonnych,
- ból głowy,
- ból pleców,
- osłabienie.
Okres wysypkowy
Wysypka utrzymuje się przez okres 2-4 tygodni. Po odpadnięciu strupków, na skórze pozostają głębokie blizny, które zanikają po upływie 1-4 lat.
Czynniki ryzyka zachorowania i powikłania ospy małpiej
Czynniki ryzyka zachorowania na małpią ospę:
- bezpośredni kontakt z krwią, płynami ustrojowymi lub zmianami skórnymi chorego zwierzęcia bądź człowieka,
- spożywanie nieodpowiednio przygotowanych produktów z mięsa zakażonych zwierząt,
- bliski, długi kontakt z osobą zakażoną,
- noworodki – przez zakażoną matkę poprzez łożysko lub w trakcie porodu.
Powikłania małpiej ospy
- głębokie blizny po zmianach skórnych,
- przy ciężkich postaciach – zaburzenia funkcji narządów wewnętrznych.
Diagnostyka ospy wietrznej i ospy małpiej
Diagnostyka ospy wietrznej odbywa się głównie na podstawie objawów. Testy molekularne wykrywające materiał genetyczny wirusa nie są rutynowo stosowane. Badania laboratoryjne na ospę wietrzną wykonywane są przede wszystkim dla wykrycia w krwi żylnej specyficznych przeciwciał przeciwko antygenom VZV. Jest to przydatne w diagnozowaniu zakażenia pierwotnego, jak i reaktywacji wirusa. Wzrost poziomu przeciwciał w klasie IgG może świadczyć o skutecznej odpowiedzi immunologicznej po przebytym zakażeniu lub po szczepieniu.

Ospa małpia jest diagnozowana obecnie w laboratoriach wyspecjalizowanych w diagnostyce ospy prawdziwej i ospy małpiej. Badania polegają na identyfikacji materiału genetycznego wirusa małpiej ospy w materiale pobranym od pacjenta (krew, wydzielina z pęcherzyków) metodą PCR.
Leczenie ospy wietrznej i ospy małpiej
Leczenie ospy wietrznej – w łagodnych przypadkach stosowane jest leczenie objawowe: leki przeciwgorączkowe, przeciwbólowe i środki łagodzące świąd. W ciężkich postaciach rekomendowany jest acyklovir podawany doustnie lub dożylnie. Hospitalizacja ma miejsce rzadko i dotyczy osób z upośledzoną odpornością i powikłaniami.
Leczenie ospy małpiej – obecnie stosuje się leczenie objawowe: środki odkażające i przeciwświądowe, a także leki przeciwgorączkowe i przeciwbólowe.
- Osoby podejrzane o zachorowanie na małpią ospę podlegają obowiązkowej hospitalizacji.
- Osoby, które miały styczności (bliski kontakt) z osobą podejrzaną o zachorowanie na ospę małpią podlegają obowiązkowej kwarantannie lub nadzorowi epidemiologicznemu do czasu potwierdzenia, lub wykluczenia zakażenia u osoby, która była źródłem narażenia.
- Osoby, które miały styczność (bliski kontakt) z osobą zakażoną ospą małpią podlegają obowiązkowej kwarantannie przez okres do 21 dni, licząc od dnia następującego po narażeniu.
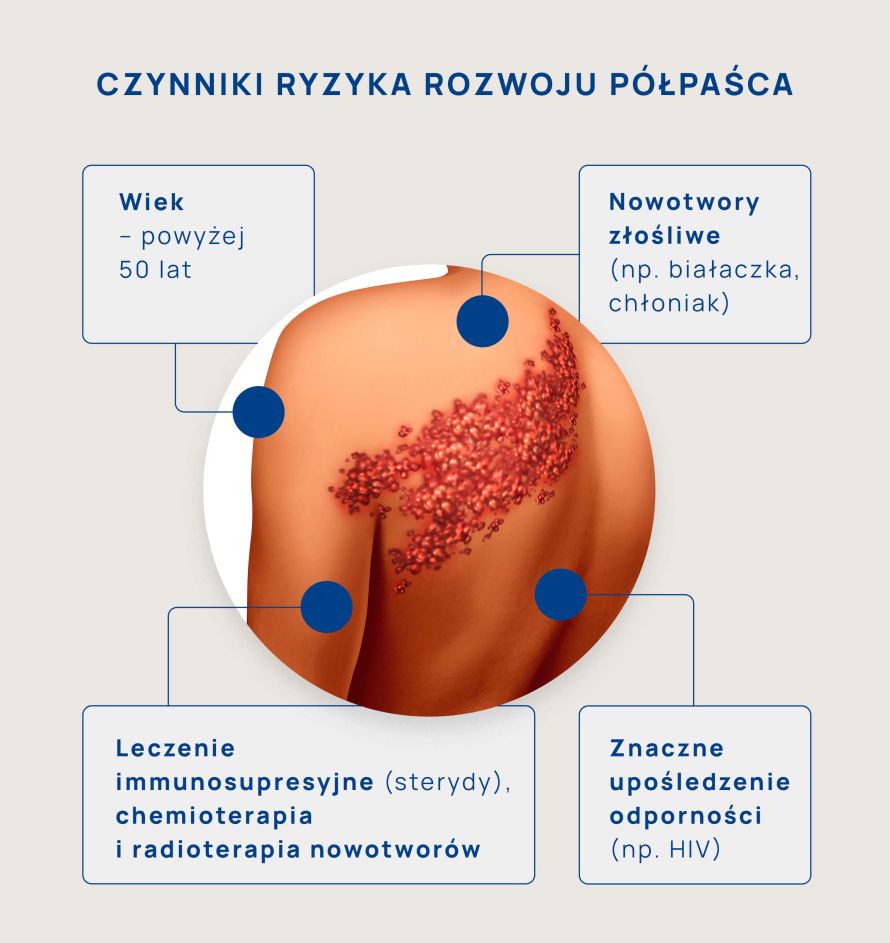
Przeczytaj też: Półpasiec – choroba jednej połowy ciała