Tocząca się za naszą wschodnią granicą wojna oraz ewentualne zagrożenie atakiem nuklearnym spowodowały, iż powróciło zainteresowanie płynem Lugola i tabletkami z jodem. Dlatego w naszym artykule postaramy się odpowiedzieć na pytania:
- Czy promieniowanie radioaktywne rzeczywiście powoduje raka tarczycy?
- Czy warto zażywać profilaktycznie płyn Lugola i czy jego zażywanie jest bezpieczne?
- Jakie znaczenie w obecnej sytuacji ma spożycie jodowanej soli?
- Skąd możemy wiedzieć, jaki jest poziom jodu w organizmie?
Zapraszamy do lektury!
FAKT: Promieniowanie radioaktywne może powodować raka tarczycy
Ewentualna emisja promieniowania jonizującego i substancji promieniotwórczych jest potencjalnym źródłem izotopów jodu. Po przedostaniu się do organizmu pierwiastek gromadzi się w tarczycy, co może być związane z rozwojem raka tego narządu. Największe ryzyko powstania tego nowotworu występuje u dzieci – do 12 r.ż. – i jest zależne od dawki izotopu jodu. Osoby starsze – powyżej 20 r.ż, a zwłaszcza po 40 r.ż. – mają znikome prawdopodobieństwo powstania raka tarczycy pod wpływem promieniowania radioaktywnego.
MIT: Wskazane jest profilaktyczne stosowanie płynu Lugola
Zażycie płynu Lugola powoduje, iż tarczyca przestaje wychwytywać jod. Problem jednak w tym, iż jest to efekt krótkotrwały – trwa nie dłużej niż dobę – po którym tarczyca ponownie zaczyna wychwytywać jod z krwi. Dlatego stosowanie płynu Lugola w celach profilaktycznych nie jest wskazane.
FAKT: Stosowanie płyny Lugola w celach profilaktycznych może być szkodliwe
Przyjęcie płynu Lugola, czyli zbyt dużej ilości jodu jednorazowo, może być szkodliwe dla wielu grup osób.
Szczególnie ostrożne powinny być osoby z predyspozycją do choroby autoimmunologicznej tarczycy oraz osoby chore. Chodzi zwłaszcza o chorobę Graves-Basedowa, która przebiegała z nadczynnością tarczycy, a obecnie jest w remisji. Stosowanie płynu Lugola może uaktywnić chorobę.

Inna grupa osób to pacjenci z chorobą Hashimoto, u których zażycie jednorazowej dużej dawki jodu może przyspieszyć pojawienie się niedoczynności tarczycy. A jeśli ta niedoczynność już występuje, może się pogłębić.

Poza pacjentami z chorobami tarczycy, zbyt duża ekspozycja na jod może być szkodliwa dla wcześniaków oraz noworodków, po operacjach tarczycy oraz z niewydolnością nerek. Przeciwwskazania do podawania jodu obejmują również alergię na jod oraz opryszczkowate zapalenie skóry.
MIT: Podanie płynu Lugola w celach profilaktycznych jest nadal rekomendowane przez lekarzy
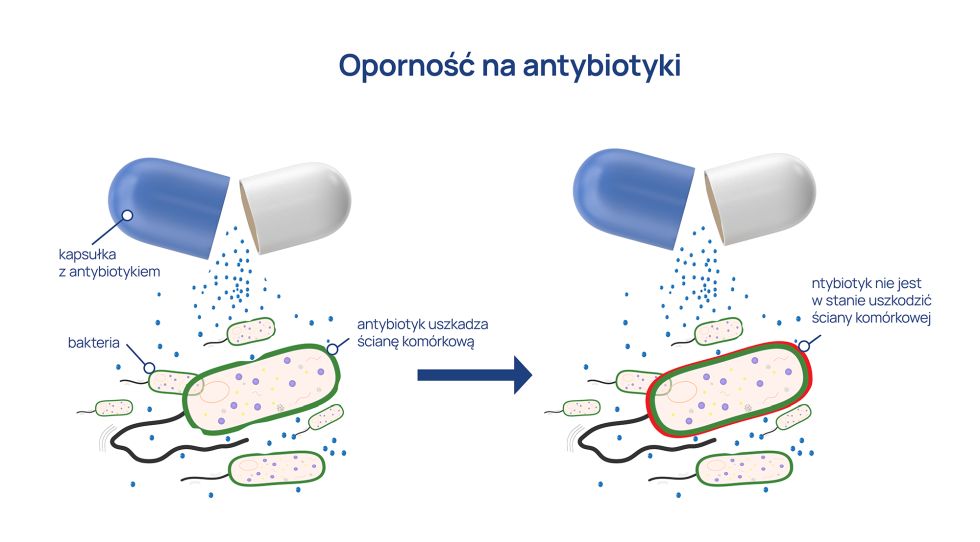
Płyn Lugola to wodny roztwór czystego jodku potasu, zawierający aż 5-8 mg jodu w jednej kropli płynu, co przekracza 25-50 razy dobowe zapotrzebowanie na jod. Jego podanie wywołuje blokadę tarczycy, która broniąc się przed nadmierną podażą jodu w organizmie, zmniejsza transport tego pierwiastka do gruczołu i syntezę hormonów. Z tego powodu płyn Lugola zastosowano w Polsce po wybuchu w elektrowni atomowej w Czernobylu. Jednak obecnie nie rekomenduje się tego roztworu w celach profilaktycznych w sytuacji zagrożenia promieniowaniem radioaktywnym.
FAKT: Wzbogacanie żywności (np. soli) w jod obniża jodochwytność tarczycy, co zmniejsza narażenie na wchłanianie radioaktywnego jodu
W Polsce prowadzi się profilaktykę jodową, polegającą na jodowaniu soli kuchennej. Dzięki temu zmniejszyła się gotowość tarczycy do wychwytywania jodu z krwi i – w przypadku ewentualnego skażenia – ryzyko kumulacji radioaktywnego pierwiastka jest znacznie niższe. Dlaczego? Organizm, w którym poziom jodu jest wystarczający nie będzie już tak chętnie wychwytywał pierwiastka skażonego.
MIT: Najlepszym sposobem na sprawdzenie poziomu jodu w organizmie jest posmarowanie skóry jodyną i obserwacja, jak szybko się wchłania
W ostatnim czasie w internecie opisywany jest test na sprawdzenie poziomu jodu w organizmie, polegający na posmarowaniu skóry jodyną i obserwacji jak szybko się wchłania. Niestety w ten sposób nie sprawdzimy, czy rzeczywiście mamy niedobór jodu. Po pierwsze dlatego, iż wchłanianie jodu przez skórę zależy głównie od innych czynników niż jego poziom w organizmie, np. od temperatury otoczenia. Poza tym ocena szybkości tego wchłaniania jest subiektywna a dawka, którą smarujemy skórę nieokreślona.
Jak zatem sprawdzić poziom jodu w organizmie? Jedynym obiektywnym sposobem jest zwalidowany test laboratoryjny polegający na określeniu poziomu jodu w moczu.