Spis treści
- Czy przed badaniem krwi można jeść?
- Czy i co można pić przed badaniem krwi?
- Czy przed badaniem krwi można palić?
- Czy można brać leki przed badaniem krwi?
- Czy można ćwiczyć przed badaniem krwi?
- Co jeszcze może wpłynąć na wynik badania?
Przygotowanie do badań laboratoryjnych jest kluczową częścią procesu przedanalitycznego, ale może też być źródłem błędów. Niezależnie od faktycznego stanu zdrowia pacjenta, na wynik badania – oprócz pracy laboratorium – istotny wpływ ma odpowiednie przygotowanie do badania (jest to istotna część procesu przedanalitycznego).
Błędy przedanalityczne to błędy, które mogą się pojawić od momentu zlecenia badania laboratoryjnego przez lekarza, do momentu, kiedy próbka jest gotowa do analizy. Szacuje się, że błędy przedanalityczne stanowią około 60-75% błędów w diagnostyce laboratoryjnej.
Sam pacjent może być potencjalnym źródłem błędu przedanalitycznego (np. stosując nieodpowiednią dietę, przyjmując suplementy, używki, wykonując wysiłek fizyczny przed pobraniem materiału do badań).
Dlatego też przy udziale European Federation of Clinical Chemistry and Laboratory Medicine (EFLM) i Latin America Confederation of Clinical Biochemistry (COLABIOCLI) opracowano wspólne zalecenia i wytyczne dotyczące pobierania krwi żylnej, rekomendowane przez Krajową Izbę Diagnostów Laboratoryjnych oraz Polskie Towarzystwo Diagnostyki Laboratoryjnej.
Czy przed badaniem krwi można jeść?
Generalną zasadą jest, że krew na wszystkie badania należy pobierać od pacjenta rano (pomiędzy godziną 7 a 9), na czczo, 12 godzin po ostatnim posiłku.
- Kolacja powinna być lekka, a po niej nie wolno już nic zjeść – nawet kawałka jabłka czy chleba. Trzeba zrezygnować także z żucia gumy, pastylek odświeżających oddech i picia czegokolwiek poza niegazowaną wodą.
W sytuacjach awaryjnych lub w przypadku wykonywania oznaczeń, które nie wymagają powstrzymania się od spożywania posiłków, dopuszcza się pobieranie krwi od pacjenta w ciągu dnia.
- Jeżeli krew pobierana jest od pacjenta po posiłku lub pacjent nie jest odpowiednio przygotowany, należy to odnotować w dokumentacji, ponieważ informacja ta zostanie wzięta pod uwagę podczas interpretacji wyników.
Czy i co można pić przed badaniem krwi?
Dopuszcza się picie wody (niegazowanej) w przeciągu 12 godzin przed badaniem.
- Na 30-60 minut przed samym pobraniem materiału, zaleca się wypicie szklanki wody.
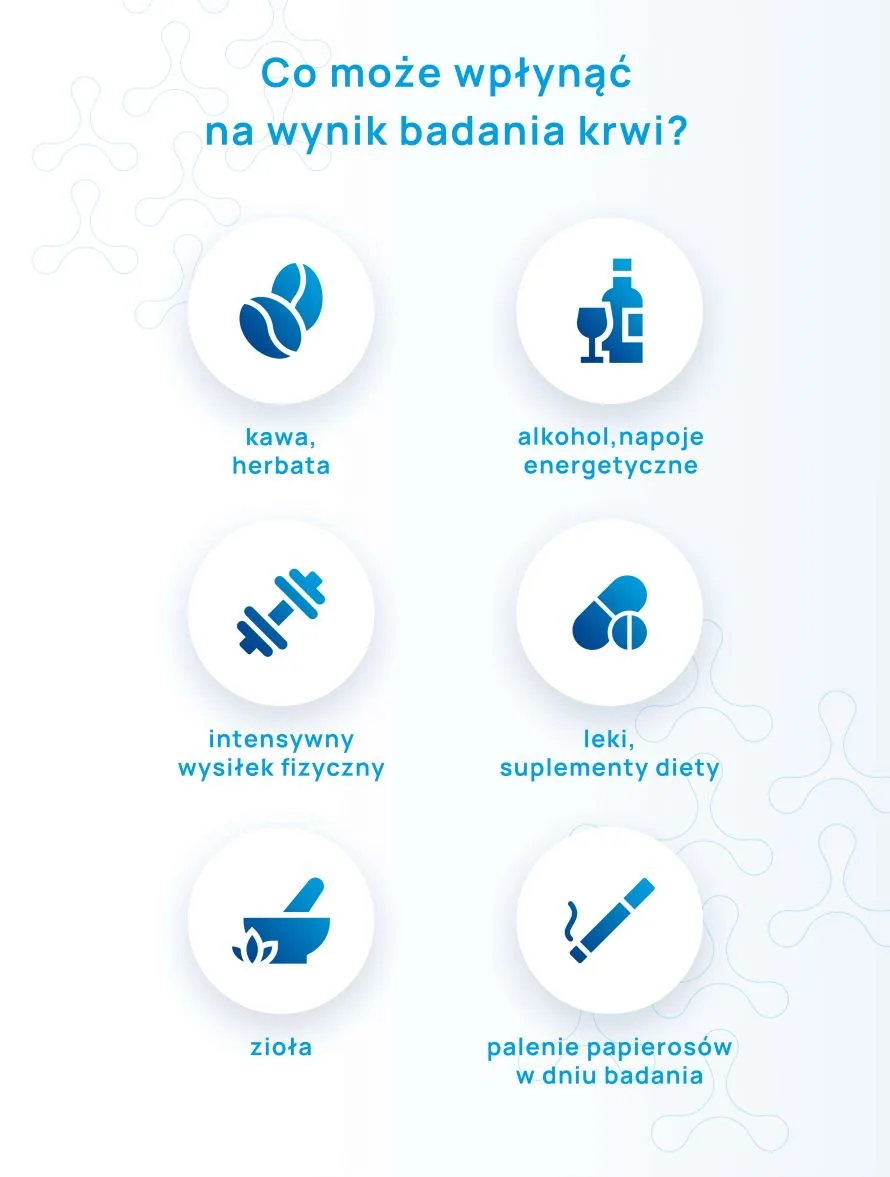
- W ciągu 24 godzin poprzedzających pobranie krwi należy bezwzględnie powstrzymać się od spożywania napojów alkoholowych oraz kawy, herbaty i napojów energetycznych.
Jak picie kawy może wpłynąć na wynik badania krwi?
Wpływ kofeiny:
- inicjuje glikogenolizę, powodując wzrost stężenia glukozy,
- aktywuje lipazę – co może spowodować wzrost kwasów tłuszczowych nawet trzykrotnie,
- zwiększa stężenie mineralokortykosteroidów i katecholamin, powoduje wzrost GFR oraz spadek zwrotnego wchłaniania elektrolitów.
Jak picie alkoholu może wpłynąć na wynik badania krwi?
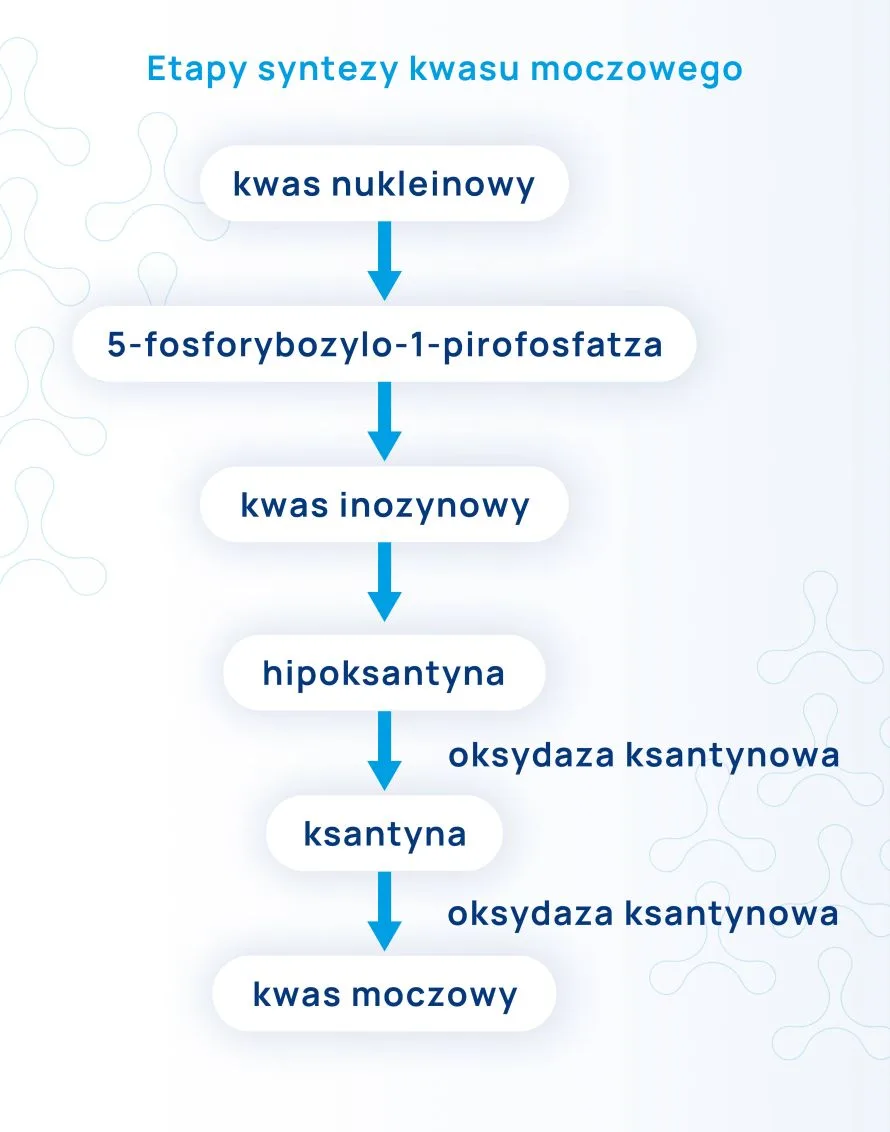
Wyróżniamy szybkie (2-4 godziny po spożyciu) i opóźnione w czasie możliwe zmiany w stężeniach parametrów spowodowane alkoholem. Alkohol jest metabolizowany do aldehydu octowego, następnie do octanu, czego efektem jest zwiększona synteza kwasu moczowego w wątrobie. Powstająca kwasica metaboliczna jest wynikiem obniżenia stężenia wodorowęglanów we krwi wywołanego przez octan i mleczany
Alkohol wywołuje ostre zmiany występujące już po 2-4 godzinach i są to:
- obniżenie stężenia glukozy (zahamowanie glukoneogenezy w wątrobie),
- podwyższone stężenia mleczanów.
Zmiany przewlekłe (opóźnione w czasie) to:
- wzrost aktywności enzymów wątrobowych AST, ALT, GGTP,
- wzrost desialowanych form transferyny (marker spożycia alkoholu),
- wzrost poziomu triglicerydów,
- następują zmiany w morfologii (wzrost MCV).
Nasilona diureza jest wynikiem wzrostu stężenia reniny i aldosteronu.
Czy przed badaniem krwi można palić?
Rano przed pobraniem krwi pacjent nie powinien palić papierosów, nie należy również żuć gumy.
- Po wypaleniu papierosa w ciągu 1-5 godzin następuje wzrost stężenia kwasów tłuszczowych, adrenaliny, kortyzolu, wolnego glicerolu i aldosteronu.
- Długotrwałe palenie ma wpływ na: liczbę krwinek białych we krwi, stężenie lipoprotein, aktywność enzymów, poziom hormonów, witamin, markerów nowotworowych i metali ciężkich.
Czy można brać leki przed badaniem krwi?
Przed pobraniem krwi nie należy też przyjmować leków (badanie powinno być wykonane przed przyjęciem kolejnej dawki leku, o ile lekarz nie zaleci inaczej), o ile nie jest to niezbędne.
W przypadku monitorowanej terapii lekami:
- Godzina pobrania krwi w celu monitorowania terapeutycznego stężenia leków zależy od oznaczanej substancji i celu wykonania badania (dostosowanie dawki leku; monitorowanie odpowiedzi organizmu na lek, działań niepożądanych, toksyczności itp.).
- W przypadku oznaczania terapeutycznego stężenia leku należy przestrzegać zaleceń dotyczących czasu pobrania krwi, określonych przez lekarza zlecającego badanie.
Czy można ćwiczyć przed badaniem krwi?
Na 24 godziny przed pobraniem krwi pacjent powinien powstrzymać się od intensywnego wysiłku fizycznego (przekraczającego zwyczajowy poziom codziennej aktywności).
Intensywny wysiłek fizyczny powoduje:
- wzrost adrenaliny, noradrenaliny, glukagonu, somatotropiny, kortyzolu, ACTH i glukozy,
- powoduje obniżenie stężenia insuliny,
- może po nim nastąpić wzrost liczby leukocytów.
Wzrost aktywności niektórych enzymów (np. CK – kinazy kreatynowej) wywołany hipoksją zależy od wytrenowania organizmu (im mniejsze przyzwyczajenie do wysiłku, tym bardziej nasilony wzrost).
Wysiłek fizyczny zwiększa stężenie parametrów zależnych od masy mięśniowej: kreatyniny, mioglobiny, LDH, AST. Powoduje też aktywację układu krzepnięcia: spadek PT i APTT, wzrost D-dimerów, również wzrost liczby płytek.
Intensywny wysiłek może spowodować pojawienie się większej liczby erytrocytów i leukocytów w moczu.
Krótkotrwałe ćwiczenia przyczyniają się do powstania zjawiska hemokoncentracji, które wynika z przemieszczania się płynów z przestrzeni wewnątrznaczyniowej do tkanek pracujących mięśni. Efektem tego jest zwiększenie hematokrytu, wzrost stężenia hemoglobiny i białek osoczowych.
Co jeszcze może wpłynąć na wynik badania?
Istnieją również inne czynniki, które mogą potencjalnie mieć wpływ na stężenie określonych substancji we krwi, jak spożyte potrawy (dieta), suplementy diety czy preparaty ziołowe.
Dieta, suplementy i zioła
- Dieta: ważne, żeby ostatni posiłek przed badaniem był lekkostrawny.
- Suplementy diety: szczególnie biotyna, która bardzo rzadko jest w niedoborze, ale jest suplementowana w trosce o piękne włosy i paznokcie; w wysokich dawkach biotyna zmienia wyniki oznaczeń immunochemicznych.
60% populacji ogólnej uważa, że leki ziołowe są bezpieczne i efektywne. Tymczasem zioła mogą m.in. uszkadzać wątrobę, czy obniżać stężenie glukozy.
Zioła poprzez interakcje z lekami (antagonistami witaminy K) mają wpływ na wynik INR. Np. dziurawiec, żen-szeń, białko soi – obniża INR; imbir, szałwia, rumianek pospolity, mleczko pszczele – podwyższa INR.
Zaburzenia rytmu okołodobowego, pora dnia i pora roku
Zaburzenia rytmu dobowego, związane np. z pracą w nocy (nieprzespana noc) lub zmianą strefy czasowej mogą powodować np. wzrost stężenia glukozy i cholesterolu, kortyzolu, TSH, prolaktyny.
Przykładowo, stężenie potasu jest niższe po południu niż rano, podczas gdy stężenie kortyzolu spada w ciągu dnia – wieczorem jest najniższe, rośnie w nocy, szczyt osiąga nad ranem (wyrzut sterydów następuje około 4-5 rano). Zmienność okołodobowa kortyzolu może również spowodować otrzymanie nieprawidłowych wyników testu obciążenia glukozą, jeśli np. test ten przeprowadza się po południu. Dlatego też zakresy referencyjne ustala się między godziną 7 a 9 rano.
W zależności od pory roku zmienia się:
- poziom hormonów tarczycy – poziom hormonu T3 jest niższy latem niż zimą o 20%. Zatem poziom TSH (hormon przysadki) jest wyższy latem,
- poziom witaminy D3 może być wyższy latem, ze względu na syntezę skórną (stopień nasłonecznienia),
- poziom cholesterolu również może się różnić zimą i latem.
Podane przykłady pokazują, jak ważne jest odpowiednie przygotowanie pacjenta do badań.
Istotne jest również to, żeby sam pacjent miał świadomość, że jego postępowanie przed pobraniem materiału do badań może mieć wpływ na ostateczny wynik badania laboratoryjnego.